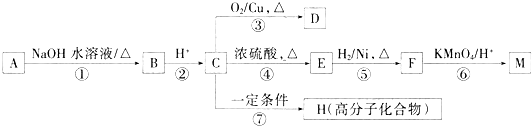
题目内容
如图为现行的元素周期表,请回答下列有关问题:
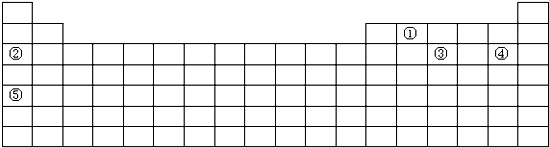
(1)在元素周期表中第 纵行所含元素种类最多.
(2)写出③的离子结构示意图 .
(3)写出①的最高价氧化物的电子式 .
(4)在元素②的单质和元素⑤的单质中,熔点最低的是 (用名称表示).
(5)写出实验室制备④的单质的离子方程式 .
(6)在元素周期表中前7个周期元素的种数如下表所示:
请分析上表中周期数与元素种类的关系,然后预测第八周期最多可能含有的元素种数为 .
(7)居里夫人发现的镭是元素周期表中第七周期,ⅡA元素.下面关于镭的性质的描述中不正确的是 .
A.在化合物中呈+2价
B.单质能与水反应,放出氢气
C.氢氧化物呈两性
D.碳酸盐难溶于水.

(1)在元素周期表中第
(2)写出③的离子结构示意图
(3)写出①的最高价氧化物的电子式
(4)在元素②的单质和元素⑤的单质中,熔点最低的是
(5)写出实验室制备④的单质的离子方程式
(6)在元素周期表中前7个周期元素的种数如下表所示:
| 周期数 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
| 元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
(7)居里夫人发现的镭是元素周期表中第七周期,ⅡA元素.下面关于镭的性质的描述中不正确的是
A.在化合物中呈+2价
B.单质能与水反应,放出氢气
C.氢氧化物呈两性
D.碳酸盐难溶于水.
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:依据元素周期表可知:①是碳,②为钠,③为磷,④为氯,⑤为铯,
(1)第三列中由于含有镧系和锕系,故含有的元素数最多;
(2)③为磷,磷离子为最外层得到3个电子,达到8个电子稳定结构,据此解答即可;
(3)C能形成的最高价氧化物为二氧化碳,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
(4)同一主族金属元素,原子序数越大,熔点越低;
(5)实验室采取二氧化锰与浓盐酸共热制取氯气;
(6)依据所给信息,得出第八周期最多可能含有的元素种数;
(7)镭是周期表第7周期IIA族的元素,与Mg、Ca等金属同主族,根据同主族元素对应单质、化合物的性质的相似性和递变性解答.
(1)第三列中由于含有镧系和锕系,故含有的元素数最多;
(2)③为磷,磷离子为最外层得到3个电子,达到8个电子稳定结构,据此解答即可;
(3)C能形成的最高价氧化物为二氧化碳,CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子;
(4)同一主族金属元素,原子序数越大,熔点越低;
(5)实验室采取二氧化锰与浓盐酸共热制取氯气;
(6)依据所给信息,得出第八周期最多可能含有的元素种数;
(7)镭是周期表第7周期IIA族的元素,与Mg、Ca等金属同主族,根据同主族元素对应单质、化合物的性质的相似性和递变性解答.
解答:
解:依据元素周期表可知:①是碳,②为钠,③为磷,④为氯,⑤为铯,
(1)第三列中由于含有镧系和锕系,故含有的元素数最多,故答案为:3;
(2)③为磷,磷离子为最外层得到3个电子,达到8个电子稳定结构,离子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故答案为:
,故答案为: ;
;
(4)同一主族金属元素,原子序数越大,熔点越低,故熔点Na小于Cs,故答案为:铯;
(5)实验室制取氯气是二氧化锰和浓盐酸共热,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++2H2O+C12↑,故答案为:MnO2+4H++2Cl-
Mn2++2H2O+C12↑;
(6)依据所给信息,得出第八周期最多可能含有的元素种数为32,故答案为:32;
(7)A.镭是周期表第7周期IIA族的元素,最外层有2个电子,则在化合物中呈现+2价,故A正确;
B.镭的金属性比Ca、Ba等强,能与水发生剧烈反应,放出氢气,故B正确;
C.Ca、Ba为金属性很强的元素,同主族元素从上到下元素的金属性逐渐增强,则镭对应的氢氧化物具有强碱性,故C错误;
D.已知碳酸镁、碳酸钙难溶于水,根据同主族元素对应单质、化合物的性质的相似性可知,镭的碳酸盐难溶于水,故D正确,
故选:C.
(1)第三列中由于含有镧系和锕系,故含有的元素数最多,故答案为:3;
(2)③为磷,磷离子为最外层得到3个电子,达到8个电子稳定结构,离子结构示意图为:
 ,故答案为:
,故答案为: ;
;(3)CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为
 ,故答案为:
,故答案为: ;
;(4)同一主族金属元素,原子序数越大,熔点越低,故熔点Na小于Cs,故答案为:铯;
(5)实验室制取氯气是二氧化锰和浓盐酸共热,反应的离子方程式为:MnO2+4H++2Cl-
| ||
| ||
(6)依据所给信息,得出第八周期最多可能含有的元素种数为32,故答案为:32;
(7)A.镭是周期表第7周期IIA族的元素,最外层有2个电子,则在化合物中呈现+2价,故A正确;
B.镭的金属性比Ca、Ba等强,能与水发生剧烈反应,放出氢气,故B正确;
C.Ca、Ba为金属性很强的元素,同主族元素从上到下元素的金属性逐渐增强,则镭对应的氢氧化物具有强碱性,故C错误;
D.已知碳酸镁、碳酸钙难溶于水,根据同主族元素对应单质、化合物的性质的相似性可知,镭的碳酸盐难溶于水,故D正确,
故选:C.
点评:本题考查元素周期表与元素周期律,难度中等,侧重考查学生分析推理能力及同主族元素化合物性质的相似性与递变性,注意对对数学归纳法的应用.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )| A、质量增加6.4g |
| B、质量增加12.8g |
| C、质量减少6.4g |
| D、质量减少12.8g |
下列依据相关实验得出的结论正确的是( )
| A、将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 |
| B、将某气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2 |
| C、取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+ |
| D、在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
下列关于物质性质的描述错误的是( )
| A、硝酸是易挥发的强酸 |
| B、纯碱溶液能使酚酞溶液品红色 |
| C、CO是无色难溶于水的气体 |
| D、Fe3+可以与KSCN溶液反应生成血红色沉淀 |
一定量的氢气在一定条件下完全燃烧生成气态水,放出热量为△H1;等量的氢气在同样条件下完全燃烧生成液态水,放出热量为△H2;△H1与△H2的关系为( )
| A、△H1<△H2 |
| B、△H1=△H2 |
| C、△H1>△H2 |
| D、无法确定 |