题目内容
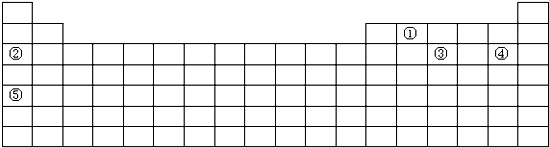
 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )| A、质量增加6.4g |
| B、质量增加12.8g |
| C、质量减少6.4g |
| D、质量减少12.8g |
考点:原电池和电解池的工作原理
专题:
分析:电解NaOH溶液,C为阴极,电极反应为2H++2e-=H2↑,D为Y阳极,电极反应为4OH--4e-=O2↑+2H2O,精炼粗铜,F为电解池的阳极,应为粗铜,E为电解池的阴极,为纯铜,电极反应为Cu2++2e-=Cu,以此解答该题.
解答:
解:D为Y阳极,电极反应为4OH--4e-=O2↑+2H2O,A池D极产生的气体在标准状况下为2.24L,n(O2)=
=0.1mol,转移电子0.4mol,E为电解池的阴极,为纯铜,电极反应为Cu2++2e-=Cu,则应生成0.2molCu,质量为0.2mol×64g/mol=12.8g,故选B.
| 2.24L |
| 22.4L/mol |
点评:本题考查电解池的工作原理,根据电极反应进行计算,题目难度中等,整个电路转移电子数相等,为解答该题的关键,比较容易.

练习册系列答案
相关题目
下列有关溶液组成的描述合理的是( )
| A、在Fe2(SO4)3溶液中可以大量存在:K+、Fe2+、Cl-、Br-、SCN- | ||
| B、c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3- | ||
C、加水稀释时
| ||
| D、在碱性溶液中可以大量存在:S2O32-、AlO2-、SiO32-、S2-、Na+ |
某元素原子最外层只有1个电子,它跟卤素相结合时,所形成的化学键是( )
| A、一定形成共价键 |
| B、一定形成离子键 |
| C、可能形成共价键,也可能形成离子键 |
| D、以上说法都不对 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 LCO2所含的原子数为1.5NA | ||
| B、常温常压下,48 g O3含有的氧原子数为3NA | ||
| C、标准状况下,22.4 L SO3中所含原子数为4NA | ||
D、标准状况下,1 L水所含分子数为
|
下列关于电子式的说法不正确的是( )
| A、每种元素的原子都可以写出电子式 |
| B、简单阳离子的电子式与它的离子符号相同 |
| C、阴离子的电子式要加方括号表示 |
| D、电子式就是核外电子排布的式子 |
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍.下列说法不正确的是( )
| A、原子半径:Z>W>R |
| B、对应的氢化物的热稳定性:R>W |
| C、W离子的还原性强于R离子 |
| D、W与X、W与Z形成的化合物的化学键类型完全相同 |
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下. 煤是重要的能,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能,也是生产化工产品的重要原料.试用所学知识,解答下列问题: