题目内容
9.下列关于硅的说法中错误的是( )| A. | 粗硅是由焦炭和二氧化硅在电炉中反应制得 | |
| B. | 硅的化学性质不活泼,常温下只与F2、HF、强碱反应 | |
| C. | 单质硅的主要用途为制造半导体材料和硅合金的原料 | |
| D. | SiO2制成的玻璃纤维,由于电能力强而被用于制造光缆 |
分析 A、利用碳的还原性强于硅,可用焦炭在电炉中还原二氧化硅得到含少量杂质的粗硅;
B、常温下硅的化学性质稳定,硅的亲氟性可以与F2、HF反应生成四氟化硅,硅与氢氧化钠反应生成硅酸钠和氢气;
C、Si属于半导体,据此来确定其用途;
D、二氧化硅属于原子晶体,不能导电;
解答 解;A、工业上,用焦炭在电炉中还原二氧化硅SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2C0↑,得到含少量杂质的粗硅,故A正确;
B、常温下硅的化学性质稳定,硅的亲氟性可以与F2、HF反应生成四氟化硅,硅与氢氧化钠反应生成硅酸钠和氢气,故B正确;
C、Si属于半导体,是重要的半导体材料和硅合金的原料,故C正确;
D、SiO2制成的玻璃纤维,由于传导光能力强而被用于制造通讯光缆,故D错误;
故选D.
点评 本题考查硅在自然界中的存在形式以及硅和二氧化硅的性质和用途知识,较简单,注重基础知识的考查,注意元素的存在与性质的关系.

练习册系列答案
相关题目
19.X、Y为短周期元素,X原子各电子层的电子数的比值为1:4:1,它比Y原子少5个电子.下列叙述正确的是( )
| A. | 离子半径顺序为X>Y | |
| B. | X、Y形成的化合物含共价键和离子键 | |
| C. | XY2分子中所有原子最外层均达到8电子稳定结构 | |
| D. | Y单质与氢气的混合气体光照条件下容易发生爆炸 |
20.关于等物质的量的12C和14C的叙述中正确的是( )
①含有相同数目的原子;②含有相同物质的量的质子;③属于同种元素;④具有相同的质量;⑤中子数相等;⑥电子数相等;⑦与氧气完全反应生成CO2时,消耗氧气的量相同;⑧几乎相同的化学性质.
①含有相同数目的原子;②含有相同物质的量的质子;③属于同种元素;④具有相同的质量;⑤中子数相等;⑥电子数相等;⑦与氧气完全反应生成CO2时,消耗氧气的量相同;⑧几乎相同的化学性质.
| A. | 只有②③⑤ | B. | 只有 ①②③ | C. | 除④、⑤外均正确 | D. | 全部正确 |
3.下列说法正确的是( )
| A. | 二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物 | |
| B. | 二氧化硅是酸性氧化物,它不溶于任何酸 | |
| C. | 二氧化碳通入水玻璃可以得到硅酸 | |
| D. | 因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 |
7.实验室制Cl2的反应为4HCl(浓)+MnO2$\frac{\underline{\;△\;}}{\;}$MnCl2+Cl2↑+2H2O,下列说法错误的是( )
| A. | 还原剂是HCl,氧化剂是MnO2 | |
| B. | 每消耗1mol MnO2,转移电子的物质的量为2 mol | |
| C. | 每转移1mol电子,则可以制得标况下Cl2 22.4L | |
| D. | 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
8.分子式为C6H12O2,属于酯类,且能发生银镜反应的同分异构体有( )
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
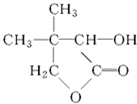 G的合成路线如图:
G的合成路线如图: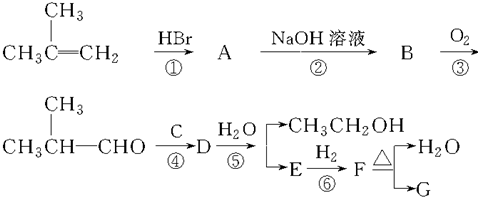
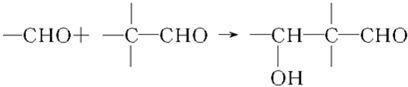
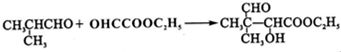
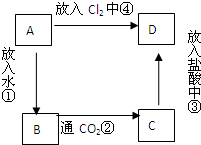 物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化:
物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化: