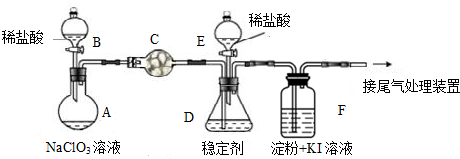
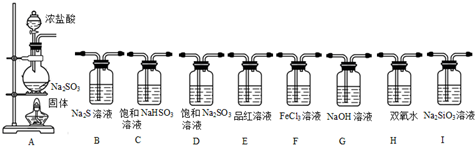
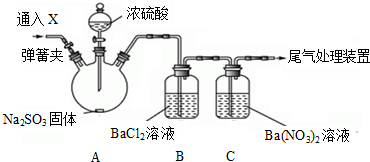
题目内容
16.(1)某温度(t℃)时,水的离子积为Kw=1×10-13,则该温度(填大于、小于或等于)大于25℃,其理由是水的电离过程吸热,该温度下的Kw比25℃时大,所以该温度大于25℃.(2)若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比:
①若所得混合液为中性,则a:b=10:1;此溶液中各种离子的浓度由大到小排列顺序是c(Na+)>c(SO42-)>c(H+)=c(OH-).
②若所得混合液的pH=2,则a:b=9:2;此溶液中各种离子的浓度由大到小排列顺序是c(H+)>c(SO42-)>c(Na+)>c(OH-).
分析 (1)水的电离是吸热反应,升高温度促进水电离,则溶液的离子积常数增大;
(2)若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,
①溶液呈中性,说明酸和碱恰好完全反应,根据溶液的酸碱性及电荷守恒确定离子浓度大小;
②若所得混合液的pH=2,根据c(H+)=$\frac{c(酸)V(酸)-c(碱)V(碱)}{V(酸)+V(碱)}$计算酸碱的体积比,根据溶液的酸碱性及物料守恒判断离子浓度大小.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,某温度(T℃)时,水的离子积常数Kw=1×10-13>10-14,则该温度大于25℃,
故答案为:大于;水的电离过程吸热,该温度下的Kw比25℃时大,所以该温度大于25℃;
(2)pH=11的NaOH溶液中氢氧根离子浓度为:c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,稀硫酸溶液中氢离子浓度为:c(H+)=0.1mol/L,则:
①若所得混合液为中性,则有:0.01a=0.1b,
解得:a:b=10:1;
混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得:c(Na+)>c(SO42- ),该溶液为盐溶液,硫酸根离子浓度大于氢离子浓度,所以离子浓度大小顺序是:c(Na+)>c(SO42-)>c(H+)=c(OH-),
故答案为:10:1; c(Na+)>c(SO42- )>c(H+)=c(OH-);
②若所得混合液的pH=2,则有:$\frac{0.1b-0.01a}{a+b}$=0.01,
解得:a:b=9:2;
溶液呈酸性,则:c(H+)>c(OH-),
溶液中氢离子浓度为0.01mol/L,硫酸根离子浓度为:$\frac{0.05×2}{2+9}$mol/L=0.009mol/L,
所以氢离子浓度大于硫酸根离子浓度,根据物料守恒知,c(SO42-)>(Na+),氢氧根离子浓度最小,
所以离子浓度大小顺序为:c(H+)>c(SO42- )>c(Na+)>c(OH-),
故答案为:9:2;c(H+)>c(SO42- )>c(Na+)>c(OH-).
点评 本题考查酸碱混合的定性判断、离子浓度大小比较,题目难度中等,注意掌握根据溶液的酸碱性及电荷守恒判断离子浓度大小的方法,注意(2)中水的离子积常数是10-13而不是10-14,为易错点.

| X | Y | Z | |
| W |
(2)X、Y、Z元素的氢化物均有两种或两种以上.
液态YH3的电离方式与液态H2Z类似,则液态YH3中阴离子的电子式为
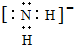
(3)以W为材料制成的容器在空气中具有自我保护作用,这种容器不能贮存强碱溶液,用离子方程式表示其原因为Al2O3+2OH-=2AlO2-+H2O、2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
△H=a kJ•mol-1.
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1.则a=-28.5.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ad(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a、b、c装置中能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).

(5)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.215×1021.
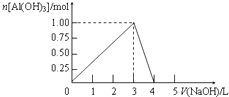 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )| A. | 反应过程中,沉淀最多时的质量为7.8g | |
| B. | AlCl3溶液的浓度为2.0 mol•L-1 | |
| C. | 得到39g沉淀时,消耗的NaOH溶液体积为1.5L或3.5L | |
| D. | 当V(NaOH)=4L时,得到的溶液中Na+、Cl-浓度相等 |
 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.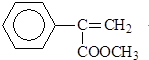 .
.
 .
.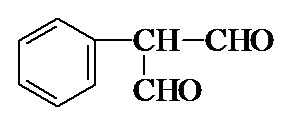 .
.