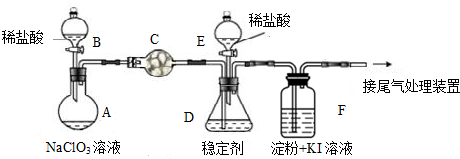
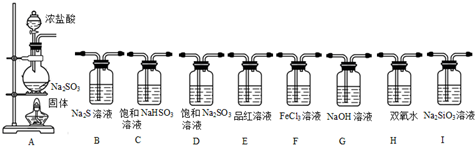
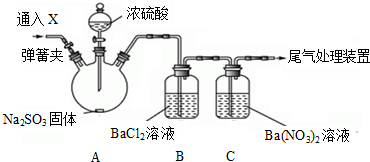
题目内容
13.下列关于NaHCO3的叙述,不正确的是( )| A. | 它是一种白色粉末,溶解度小于Na2CO3 | |
| B. | 加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 | |
| C. | 与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 | |
| D. | 它是一种碳酸盐 |
分析 A、相同条件下,碳酸氢钠的溶解度小;
B、碳酸氢钠不稳定;
C、碳酸氢钠中含碳高于碳酸钠;
D、碳酸钠是碳酸盐,而碳酸氢钠是碳酸氢盐.
解答 解:A、Na2CO3和NaHCO3在相同条件下,碳酸氢钠的溶解度小,则在水中的溶解度为:Na2CO3>NaHCO3,故A正确;
B、碳酸氢钠不稳定,碳酸氢钠也可以加热分解生成碳酸钠,故B正确;
C、碳酸氢钠中含碳高于碳酸钠,所以相同质量的NaHCO3与Na2CO3,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳,故C正确;
D、碳酸钠是碳酸盐,而碳酸氢钠是碳酸氢盐,碳酸氢钠是酸式盐,故D错误;
故选D.
点评 本题考查了碳酸钠、碳酸氢钠的性质,注重了基础知识考查,本题难度不大.

练习册系列答案
相关题目
3.化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”.下列观点正确的是( )
| A. | 大力提倡开发化石燃料作为能源 | |
| B. | 研发新型催化剂,提高石油和煤中各组分的燃烧热 | |
| C. | 化石燃料属于可再生能源,不影响可持续发展 | |
| D. | 人类应尽可能开发新能源,取代化石能源 |
1.下列盛放试剂的方法,错误的是( )
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
8.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
18.在给定条件下,可以大量共存的离子组是( )
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
5.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)$\frac{\underline{\;高温\;}}{\;}$2Fe(s)+3CO2(g)
△H=a kJ•mol-1.
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1.则a=-28.5.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为60%.
②下列说法正确的是ad(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a、b、c装置中能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).

(5)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.215×1021.
△H=a kJ•mol-1.
(1)已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)
△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1.则a=-28.5.
(2)冶炼铁反应的平衡常数表达式K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,温度升高后,K值减小(填“增大”、“不变”或“减小”).
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
②下列说法正确的是ad(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a、b、c装置中能保护铁的是bc(填字母).
②若用d装置保护铁,X极的电极材料应是锌(填名称).

(5)25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10-12,Ksp[Fe(OH)3]=2.64×10-39.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.215×1021.
2. 如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )
如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )
 如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )
如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )| A. | 开始时发生的是析氢腐蚀 | B. | -段时间后发生的是吸氧腐蚀 | ||
| C. | 两段时间内负极的电极反应相同 | D. | 两段时间内正极的电极反应相同 |
3.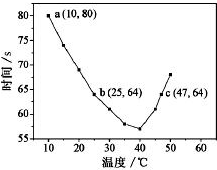 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 当NaHSO3完全消耗时的离子方程式为:6HSO3-+2IO3-=6SO42-+2I-+6H+ | |
| C. | 图中a点对应的NaHSO3反应速率为5.5×10-5mol•L-1•s-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |