题目内容
13.YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于${\;}_{39}^{89}$Y的说法正确的是( )| A. | Y在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{89}$Y是两种不同的核素 | |
| D. | 核素${\;}_{39}^{89}$Y的质子数与中子数之差为50 |
分析 Y元素为39号元素,根据构造原理,核外电子排布式1S22S22P63S23P63d104S24P6 4d15S 2,字母前的数字表示电子层数,价电子是4d15S 2,价电子数之和=族序数,所以Y属第五周期第ⅢB族,由此分析解答.
解答 解:Y元素为39号元素,根据构造原理,核外电子排布式1S22S22P63S23P63d104S24P6 4d15S 2,字母前的数字表示电子层数,价电子是4d15S 2,价电子数之和=族序数,所以Y属第五周期第ⅢB族.
A、钇在周期表中的位置是第五周期第ⅢB族,故A错误;
B、该元素是副族元素,所以是金属元素,故B错误;
C、${\;}_{39}^{89}$Y和${\;}_{39}^{89}$Y是质子数相同,中子数相同的同一元素,所以是不同的两种核素,故C正确;
D、素${\;}_{39}^{89}$Y的质子数为39,质量数为89,中子数=质量数-质子数=89-39=50,质子数与中子数之差为-11,故D错误;
故选C.
点评 本题考查了原子符号的含义、质子数、中子数、电子数之间的计算以及核素的定义,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.在1L某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 19.2g铜粉,微热,充分反应后溶液中c(Cu2+)为( )
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
1.酸雨中存在电离平衡:H2S03?H++HSO${\;}_{3}^{-}$和HSO${\;}_{3}^{-}$?H++S032-,下列说法正确的是( )
| A. | 若向H2SO3,溶液中加入氯化钙溶液,平衡向右移动,会产生亚硫酸钙沉淀. | |
| B. | 若向H2S03溶液巾加人氢氧化钠溶液,平衡向右移动,pH变大 | |
| C. | 适当升溫(假如亚硫酸不分解不挥发),平衡向左移动,电离平衡常数减小 | |
| D. | 25℃时,笫一步电离常数K,小于第二步电离常数K2 |
8. 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
(1)该小组同学向5mLlmol/LFeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(2)向5mLlmol/LFeCl3溶液中通人足量的SO2,在实验时,溶液由棕黄色变成红棕色,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色,能被Fe3+氧化为SO${\;}_{4}^{2-}$.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为缩短红棕色变为浅绿色的时间,进行了如下实验:
向步骤①和步骤②所得溶液中滴加K3[Fe(CN)6](添化学式)试剂,溶液立即出现蓝色沉淀.
(4)综合上述实验探究过程,可以获得的实验结论:
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).请回答问题:(1)该小组同学向5mLlmol/LFeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(2)向5mLlmol/LFeCl3溶液中通人足量的SO2,在实验时,溶液由棕黄色变成红棕色,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色,能被Fe3+氧化为SO${\;}_{4}^{2-}$.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(3)为缩短红棕色变为浅绿色的时间,进行了如下实验:
向步骤①和步骤②所得溶液中滴加K3[Fe(CN)6](添化学式)试剂,溶液立即出现蓝色沉淀.
| 步骤① | 往5mL1mol/LFeCl3溶液中通入SO2气体,溶液立即变为红棕色,微热在较短时间内溶液颜色变为浅绿色. |
| 步骤② | 往5mL重新配制的1mol/LFeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色,短时间内溶液颜色变为浅绿色. |
Ⅰ.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ.升高温度、提高FeCl3溶液的酸性会加快反应速率,缩短浅绿色出现的时间.
2.常温下,某溶液 A 中含有 NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、Cl-、SO42-、SO32-,现取该溶液进行有关实验,实验结果如图所示
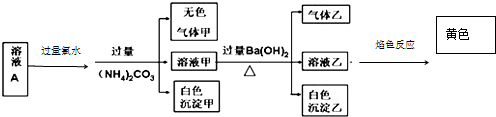
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 沉淀乙一定可溶于盐酸 | |
| B. | 溶液中一定存在 Na+、Al3+,一定没有 Fe3+、Fe2+、CO32- | |
| C. | 溶液中一定有 SO42-,可能有 K+、Cl- | |
| D. | 气体甲、乙均为无色、有刺激性气味 |
3.某短周期元素X,其原子的电子层数为n,最外层电子数为(2n+l),原子核内质子数是(2n2一l).下列有关X的说法,不正确的是( )
| A. | X是非金属元素 | |
| B. | X形成含氧酸钾盐化学式可能为KXO2、KXO3或KXO4 | |
| C. | 由X形成的含氧酸均为强酸 | |
| D. | X不可能为第一周期元素 |
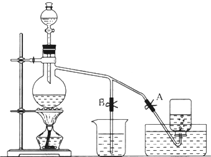 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)