题目内容
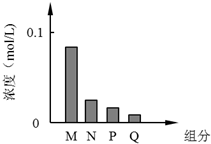 常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )
常温下,将10mL 0.2mol/L的一元酸HA与V mL等浓度的NaOH溶液混合.当V=10mL时,所得溶液中部分微粒组成及浓度如图所示.假设溶液体积可以相加,则下列说法正确的是( )| A、图中N表示HA,P表示OH-,Q表示H+ |
| B、若V=10 mL,则pH=7 |
| C、若V<10 mL,则溶液显酸性 |
| D、若V=10 mL,则:c(M)+c(P)=c(Na+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,发生反应:HA+NaOH=NaA+H2O,反应后溶液中钠离子浓度为:c(Na+)=0.2mol/L×
=0.1mol/L,若HA为强酸,则反应生成溶液为中性,存在离子有:Na+、A-、OH-、H+四种,根据图象可知,M的浓度小于0.1mol/L,则反应后的溶液中至少存在5种粒子,所以HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),即:M为A-,N为OH-,P为HA,Q为H+,据此对各选项进行判断.
| 1 |
| 2 |
解答:
解:当V=10mL时,一元酸HA和NaOH溶液等体积、等浓度0.2mol/L混合,反应后溶液中钠离子浓度为:c(Na+)=0.2mol/L×
=0.1mol/L,若HA为强酸,则反应生成溶液为中性,存在离子有:Na+、A-、OH-、H+四种,根据图象可知,M的浓度小于0.1mol/L,而c(Na+)=0.1mol/L,则反应后的溶液中至少存在5种粒子,所以HA为弱酸,NaA溶液呈碱性,则c(OH-)>c(H+),由于A-的水解程度较低,则有c(A-)>c(OH-),溶液中氢氧根离子来自水的电离和A-的水解,则c(OH-)>c(HA),所以溶液中离子浓度大小为:c(Na+)=0.1mol/L>c(A-)>c(OH-)>c(HA)>c(H+),所以:M为A-,N为OH-,P为HA,Q为H+,
A.根据以上分析 可知,M为A-,N为OH-,P为HA,Q为H+,故A错误;
B.若V=10 mL,反应生成强碱弱酸盐NaA,由于A-的水解,溶液显示碱性,溶液的pH>7,故B错误;
C.当V=10mL,溶液显示碱性,而当V<10 mL,溶液可能为酸性,有可能为碱性或中性,需要根据溶液中离子浓度大小判断,故C错误;
D.若V=10 mL,根据物料守恒可得:c(Na+)=c(A-)+c(HA),M为A-,P为HA,则:c(M)+c(P)=c(Na+),故D正确;
故选D.
| 1 |
| 2 |
A.根据以上分析 可知,M为A-,N为OH-,P为HA,Q为H+,故A错误;
B.若V=10 mL,反应生成强碱弱酸盐NaA,由于A-的水解,溶液显示碱性,溶液的pH>7,故B错误;
C.当V=10mL,溶液显示碱性,而当V<10 mL,溶液可能为酸性,有可能为碱性或中性,需要根据溶液中离子浓度大小判断,故C错误;
D.若V=10 mL,根据物料守恒可得:c(Na+)=c(A-)+c(HA),M为A-,P为HA,则:c(M)+c(P)=c(Na+),故D正确;
故选D.
点评:本题考查了酸碱混合溶液定性判断、离子浓度大小比较、溶液pH值、盐类水解等知识,题目难度中等,正确判断一元酸HA是弱酸为解题关键,能够根据电荷守恒、物料守恒、盐的水解判断溶液中各离子浓度大小.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
下列有关说法正确的是( )
| A、金属钠、镁着火时可用泡沫灭火器扑灭 |
| B、为防止试管破裂,加热固体时试管口一般要略高于试管底 |
| C、1L PH=13的Ba(OH)2溶液中含有0.2NA个OH- 离子 |
| D、1.2克CH4所含有的共价键数与0.1 mol NH3所含的共价键数相同 |
符合下列分子式的有机物,没有同分异构现象的是( )
| A、C4H10 |
| B、C12H22O11 |
| C、C3H8 |
| D、C4H8 |
化学与科技、社会、生产、生活密切相关.下列有关说法不正确的是( )
| A、物质燃烧时产生有色火焰的都是焰色反应的见证 |
| B、棉花、木材和植物秸秆的主要成分都是纤维素 |
| C、航天服主要成分由碳化硅陶瓷和碳纤维复合而成,是一种复合材料 |
| D、天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
如图所示的装置,有关说法正确的是( )


| A、电子由Cu流向Zn |
| B、Cu是正极,发生氧化反应 |
| C、溶液中Cu2+向Cu电极移动 |
| D、Cu在Zn电极上析出 |
在标准状况下,称量一个充满Cl2的容器质量为74.6g,若改充氮气,其质量为66g,则容器充满SO2气体时的质量为( )
| A、64.8 g |
| B、73.2 g |
| C、68.6 g |
| D、75.8 g |
下列变化或数据与氢键无关的是( )
| A、冰的密度比水的密度小 |
| B、氨极易溶于水 |
| C、苯酚溶于热水 |
| D、SbH3的沸点比PH3高 |
能正确表示下列反应的离子方程式是( )
| A、碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O |
| B、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+4 NH4++2H2O |
| C、硫代硫酸钠溶液中滴入稀盐酸:S2O32-+2H+=S↓+SO2↑+H2O |
| D、在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |