题目内容
18.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(2)W与Y可形成化合物W2Y,该化合物的电子式为
 .
.(3)X的硝酸盐溶液显酸性,用离子方程式解释原因:Al3++3H2O?Al(OH)3+3H+.
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+C12+2H2O═H2SO4+2HCl.
(5)比较Y、Z气态氢化物的稳定性:HCl>H2S(用分子式表示).(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是S2->Cl->Na+>Al3+.
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量.写出该反应的热化学方程式:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
分析 (1)W、X是金属元素,W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W为Na,X为Al;
(2)W与Y可形成化合物W2Y,则Y是非金属硫,该化合物为硫化钠,硫化钠为离子化合物,阴阳离子需要标出所带电荷;
(3)硝酸铝为强酸弱碱盐,铝离子部分水解,溶液显酸性;
(4)Y、Z是非金属元素,Y的低价氧化物通入Z单质的水溶液中,则Z为Cl,二氧化硫和氯气反应生成盐酸与硫酸;
(5)非金属性越强,气态氢化物越稳定;
(6)离子的电子层越多,离子半径越大;具有相同电子排布的离子,原子序数大的离子半径小;
(7)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸,0.25molCl2O7和水反应放出QkJ热量,则1molCl2O7和水反应放出4QkJ热量,注明物质聚集状态与反应热书写热化学方程式.
解答 解:(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W是金属钠,X是金属铝,氢氧化铝是两性氢氧化物,能和强碱反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(2)W与Y可形成化合物W2Y,则Y是非金属硫,该化合物为硫化钠,硫化钠是离子化合物,电子式为
故答案为:
(3)X为Al,其硝酸盐为硝酸铝,铝离子在溶液中部分水解:Al3++3H2O═Al(OH)3+3H+,溶液显示酸性,
故答案为:Al3++3H2O?Al(OH)3+3H+;
(4)Y、Z是非金属元素,Y的低价氧化物通入Z单质的水溶液中,则Z为Cl,二氧化硫和氯气反应生成盐酸与硫酸,该反应为:SO2+C12+2H2O═H2SO4+2HCl,
故答案为:SO2+C12+2H2O═H2SO4+2HCl;
(5)非金属性越强,则氢化物的稳定性越强,非金属性Cl>S,所以气态氢化物的稳定性:HCl>H2S,
故答案为:HCl;H2S;
(6)微粒电子层越多半径越大,同电子层的微粒,则核电荷数越大离子半径越小,所以离子半径大小顺序为:S2->Cl->Na+>Al3+,
故答案为:S2-;Cl-;Na+;Al3+;
(7)Z的最高价氧化物为是Cl2O7,Cl2O7和水反应生成高氯酸,0.25molCl2O7和水反应放出QkJ热量,则1molCl2O7和水反应放出4QkJ热量,所以其热化学反应方程式为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol,
故答案为:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
点评 本题考查结构性质位置关系应用,涉及电子式、盐类水解、热化学方程式书写等,题目难度中等,熟悉第三周期元素的性质变化规律及常见元素的单质和化合物的性质是解答本题的关键.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案 硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )
硝酸越稀还原产物中氮元素的化合价越低.某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出.在反应后的溶液中逐滴加入4mol•L-1 NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图.下列说法不正确的是( )| A. | D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-) | |
| B. | EF段发生化学反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 原溶液中n(NH4+)=0.012mol | |
| D. | 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
Ⅰ.向5mL 0.05mol/L FeCl3溶液中加入5mL 0.05mol/L KI溶液(反应a),平衡后分为两等份
Ⅱ.向一份加入饱和KSCN溶液,变红(反应b);加入CCl4,振荡、静置,下层显极浅的紫色
Ⅲ.向另一份加入CCl4,振荡、静置,下层显紫红色
结合实验,下列说法不正确的是( )
| A. | 反应a为:2Fe3++2I-?2Fe2++I2 | B. | Ⅱ中,反应a进行的程度大于反应b | ||
| C. | 比较氧化性:Ⅱ中,I2>Fe3+ | D. | 比较水溶液中c(Fe2+):Ⅱ<Ⅲ |
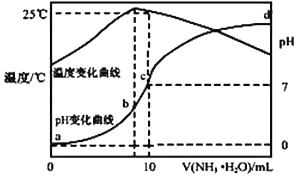 在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )
在某温度时,将 n mol•L-1氨水滴入 10mL 1.0mol•L-1 盐酸中,溶液 pH 和温度随加入氨 水体积变化曲线如图所示,下列有关说法正确的是( )| A. | a 点 Kw=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b 点:c(NH4+)>c(Cl-)>c(H +)>c(OH -) | |
| D. | 25℃时 NH4Cl 水解常数为(10n-1)×10-7mol•L-1(用 n 表示) |
| A. | 松油醇的结构简式为 ,则其同分异构体可能属于醛类、酮类或芳醇类 ,则其同分异构体可能属于醛类、酮类或芳醇类 | |
| B. | 甲烷和氯气的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 分子式为C4H8O2且能与氢氧化钠溶液反应的有机物(不考虑立体异构和醛类物质)有6种 | |
| D. | 乙醇、乙酸均能与NaOH溶液反应,因为分子中均含有-OH |
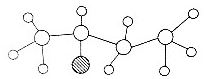
| A. | 该有机物肯定是的含烃氧衍生物 | |
| B. | 该有机物能发生取代反应和加成反应 | |
| C. | 该有机物可能是C4H9Cl | |
| D. | 该有机物可能与CH3CH2OCH2CH2互为同分异构体 |
| A. | 常温下,100 g 46%乙醇水溶液中含有H原子数为12Na | |
| B. | 23g Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为Na | |
| C. | 标准状况下,2.24 L CC14含有的共价鍵数为0.4Na | |
| D. | l molN2与4molH2反应生成的NH3分子数小于2Na |
| A. | 能生成碱的金属元素都在ⅠA族 | |
| B. | 稀有气体元素原子的最外层电子数为2或8 | |
| C. | 原子序数为14的元素位于元素周期表的第3周ⅥA族 | |
| D. | 元素周期表有18个纵行,分列16个族,即7个主族、8个副族和1个0族 |