题目内容
常温下,浓度均为0.1mol/L的6种溶液的pH如下表:
请根据上述信息回答下列问题:
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为 (用化学式表示)
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是 ;
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
(3)用离子方程式表示C溶液呈碱性的原因是 ;
(4)如果将f溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是 [已知Ksp(BaCO3)=5.1×10-9,Ksp(ZnCO3)=1.4×10-11];
(5)将浓度均为0.1mol/L的b、f等体积混合,所得溶液中各离子浓度由大到小的顺序为 ;
(6)100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)= mol/L.
| 溶液 | a | b | c | d | e | f | a |
| 溶质 | CH3COONa | NaHCO3 | NaClO | NaCN | C6H5ONa | Na2CO3 | CH3COONa |
| pH | 8.8 | 9.0 | 10.3 | 11.1 | 11.3 | 11.6 | 8.8 |
(1)上述c和d溶液所含溶质对应的酸其酸性强弱为
(2)结合表中数据分析,常温下与溶质a对水的电离程度影响相同的是
A.pH=8.8的NaOH溶液
B.pH=5.2的NH4Cl溶液
C.pH=5.2的盐酸
D.0.1mol/L的NaCN溶液
(3)用离子方程式表示C溶液呈碱性的原因是
(4)如果将f溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,首先析出的沉淀是
(5)将浓度均为0.1mol/L的b、f等体积混合,所得溶液中各离子浓度由大到小的顺序为
(6)100℃时纯水中c(H+)=10-6mol/L,在此温度下某浓度的d溶液的pH=n,则c(H+)+c(HCN)=
考点:难溶电解质的溶解平衡及沉淀转化的本质,盐类水解的原理,离子浓度大小的比较
专题:
分析:(1)弱酸根离子水解程度越大,钠盐溶液的pH越大,则对应的酸的酸性越弱;
(2)根据易水解的盐促进水的电离,酸碱抑制水的电离,据此分析;
(3)次氯酸钠在溶液中水解,溶液显碱性;
(4)依据溶度积常数比较组成相同的难溶物溶解度;
(5)Na2CO3、NaHCO3均能水解溶液显碱性,Na2CO3的水解程度大于NaHCO3的水解程度,则c(HCO3-)>c(CO32-);
(6)根据质子守恒,NaCN溶液中c(OH-)=c(H+)+c(HCN).
(2)根据易水解的盐促进水的电离,酸碱抑制水的电离,据此分析;
(3)次氯酸钠在溶液中水解,溶液显碱性;
(4)依据溶度积常数比较组成相同的难溶物溶解度;
(5)Na2CO3、NaHCO3均能水解溶液显碱性,Na2CO3的水解程度大于NaHCO3的水解程度,则c(HCO3-)>c(CO32-);
(6)根据质子守恒,NaCN溶液中c(OH-)=c(H+)+c(HCN).
解答:
解:(1)弱酸根离子水解程度越大,钠盐溶液的pH越大,则对应的酸的酸性越弱,pH:NaCN>NaClO,则酸性:HClO>HCN;
故答案为:HClO>HCN;
(2)0.1mol/L的CH3OONa溶液,促进水的电离,水电离的c(OH-)=
=10-5.2mol/L
A.pH=8.8的NaOH溶液,抑制水的电离,水电离的c(H+)=10-8.8mol/L;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离的c(H+)=10-5.2mol/L;
C.pH=5.2的盐酸,抑制水的电离,水电离的c(OH-)=
=10-8.8mol/L;
D.0.1mol/L的NaCN溶液,促进水的电离,水电离的c(H+)=10-11.1mol/L;
所以与0.1mol/L的CH3OONa溶液中水的电离程度相同的是:B;
故答案为:B;
(3)次氯酸钠在溶液中水解,溶液显碱性,其水解离子方程为ClO-+H2O?HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
(4)如果将碳酸钠溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,已知Ksp(BaCO3)=5.1×10-9mol2?L-2,Ksp(ZnCO3)=1.4×10-11 mol2?L-2;
组成相同的难溶物,溶度积越小越难溶,在溶液中越易生成沉淀,所以先沉淀的是ZnCO3;
故答案为:ZnCO3;
(5)Na2CO3、NaHCO3均能水解溶液显碱性,则c(OH-)>c(H+),Na2CO3的水解程度大于NaHCO3的水解程度,则c(HCO3-)>c(CO32-),盐的水解程度一般较小,则c(CO32-)>c(OH-),所以溶液中的离子浓度关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(6)根据质子守恒,NaCN溶液中c(OH-)=c(H+)+c(HCN),已知100℃时纯水中c(H+)=10-6mol/L,则Kw=10-12,NaCN溶液溶液的pH=n,所以c(OH-)=
=10n-12mol/L,所以c(H+)+c(HCN)=10n-12mol/L,
故答案为:10n-12.
故答案为:HClO>HCN;
(2)0.1mol/L的CH3OONa溶液,促进水的电离,水电离的c(OH-)=
| 10-14 |
| 10-8.8 |
A.pH=8.8的NaOH溶液,抑制水的电离,水电离的c(H+)=10-8.8mol/L;
B.pH=5.2的NH4Cl溶液,促进水的电离,水电离的c(H+)=10-5.2mol/L;
C.pH=5.2的盐酸,抑制水的电离,水电离的c(OH-)=
| 10-14 |
| 10-5.2 |
D.0.1mol/L的NaCN溶液,促进水的电离,水电离的c(H+)=10-11.1mol/L;
所以与0.1mol/L的CH3OONa溶液中水的电离程度相同的是:B;
故答案为:B;
(3)次氯酸钠在溶液中水解,溶液显碱性,其水解离子方程为ClO-+H2O?HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
(4)如果将碳酸钠溶液加入到含相同物质的量的BaCl2和ZnCl2的混合稀溶液中,已知Ksp(BaCO3)=5.1×10-9mol2?L-2,Ksp(ZnCO3)=1.4×10-11 mol2?L-2;
组成相同的难溶物,溶度积越小越难溶,在溶液中越易生成沉淀,所以先沉淀的是ZnCO3;
故答案为:ZnCO3;
(5)Na2CO3、NaHCO3均能水解溶液显碱性,则c(OH-)>c(H+),Na2CO3的水解程度大于NaHCO3的水解程度,则c(HCO3-)>c(CO32-),盐的水解程度一般较小,则c(CO32-)>c(OH-),所以溶液中的离子浓度关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(6)根据质子守恒,NaCN溶液中c(OH-)=c(H+)+c(HCN),已知100℃时纯水中c(H+)=10-6mol/L,则Kw=10-12,NaCN溶液溶液的pH=n,所以c(OH-)=
| Kw |
| c(H+) |
故答案为:10n-12.
点评:本题考查了盐类水解原理的应用、水解方程式、离子浓度大小比较、溶度积常数的应用、溶液中守恒关系的应用等,题目综合性较强,注重对基础知识的综合应用的考查,题目难度中等.

练习册系列答案
相关题目
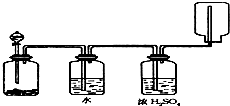 如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )
如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体,该装置可用于( )| A、二氧化锰和双氧水反应生成氧气 |
| B、浓氨水和生石灰混合生成氨气 |
| C、Na2SO3和浓H2SO4混合生成SO2 |
| D、锌粒与稀盐酸混合生成H2 |
下列说法中正确的是( )
| A、常温下,某难溶物的Ksp为2.5×105 | ||||
| B、反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | ||||
C、NH3?H2O溶液加水稀释后,溶液中
| ||||
| D、常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
下列说法正确的是( )
| A、常温下,铜与氧气很难反应,因为铜和氧气的反应是吸热反应 |
| B、金属锂在常温和加热情况下与氧气反应的产物不同 |
| C、焰色反应实验中的铂丝应用稀盐酸洗涤 |
| D、铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
在甲、乙两个密闭容器中,发生如下反应:2A(g)?B(g)+2C(s);△H=mkJ?mol-1.有如图两种图象.下列叙述正确的是( )


| A、若甲为恒容体系,图象(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B、恒温条件下,图象 (Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C、恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2molA,乙中充入1molB、3molC,则达到平衡后两容器中B的体积分数一定不同 |
| D、恒温条件下,乙容器存在图象 (Ⅱ)的关系,则当x代表压强时,y可代表B的体积分数 |
某烃1mol 最多能和2molHBr 加成反应,其所得的产物又能跟8molBr2 发生取代反应,最后得到一种只含碳、溴两种元素的化合物,则原烃为( )
| A、C4H6 |
| B、C3H4 |
| C、C3H6 |
| D、C2H2 |
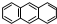 分子式C14H10)反应生成蒽醌(
分子式C14H10)反应生成蒽醌(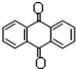 分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.
分子式C14H8O2),反应式为(未配平)C14H10(蒽)+KMnO4+H2SO4→C14H8O2(蒽醌)+K2SO4+MnSO4+H2O.