题目内容
 将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克.则
将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克.则(1)剩余固体是
(2)原混合物中Na2CO3的物质的量是
(3)已知Na2CO3和稀盐酸反应分两步进行:
Na2CO3+HC1=NaC1+NaHCO,NaHCO3+HC1=NaC1+CO2↑+H2O,
若将上述19g混合物溶于适量的水中配成溶液,在该溶液中逐滴加入1mol/L的稀盐酸,
用消耗的盐酸体积(mL)作为横坐标,反应产生的CO2的体积作为纵坐标得到如图图象:
求:A点对应溶液的溶质是
考点:钠的重要化合物
专题:几种重要的金属及其化合物
分析:(1)加热NaHCO3生成Na2CO3、CO2、H2O;
(2)加热NaHCO3生成Na2CO3、CO2、H2O,加热到质量不再改变为止,剩余固体质量为15.9g,因生成的二氧化碳和水并非固体,即减少的质量就是生成的CO2与H2O的质量之和;
(3)从0到A发生的反应为Na2CO3+HC1=NaC1+NaHCO3,A到C点发生的反应NaHCO3+HC1=NaC1+CO2↑+H2O,根据已知的碳酸钠和碳酸氢钠结合方程式计算.
(2)加热NaHCO3生成Na2CO3、CO2、H2O,加热到质量不再改变为止,剩余固体质量为15.9g,因生成的二氧化碳和水并非固体,即减少的质量就是生成的CO2与H2O的质量之和;
(3)从0到A发生的反应为Na2CO3+HC1=NaC1+NaHCO3,A到C点发生的反应NaHCO3+HC1=NaC1+CO2↑+H2O,根据已知的碳酸钠和碳酸氢钠结合方程式计算.
解答:
解:(1)加热NaHCO3生成Na2CO3、CO2、H2O,碳酸钠不分解,所以最终剩余固体为碳酸钠,故答案为:Na2CO3;
(2)设原混合物中NaHC03的质量为m,
2NaHCO3
Na2CO3+CO2↑+H2O 固体质量差值
168 44 18 62
m 19g-15.9g=3.1g
=
解得:m=8.4g
原混合物中碳酸钠的质量为:19-8.4=10.6g,则其物质的量为0.1mol;
故答案为:0.1;
(3)从0到A发生的反应为Na2CO3+HC1=NaC1+NaHCO3,则A点对应溶液的溶质是NaC1和NaHCO3;
A到C点发生的反应NaHCO3+HC1=NaC1+CO2↑+H2O,
混合物中碳酸钠的物质的量为0.1mol,碳酸氢钠的物质的量为
=0.1mol,
从0到A:Na2CO3 +HC1=NaC1+NaHCO3
0.1mol 0.1mol 0.1mol
从A到C:NaHCO3 +HC1=NaC1+CO2↑+H2O
0.2mol 0.2mol 0.2mol
则C点时消耗盐酸的体积是V=
=0.3L=300ml,
C点时产生的CO2的体积在标况下是V=nVm=0.2mol×22.4L/mol=4.48L;
故答案为:NaC1、NaHCO3;300;4.48.
(2)设原混合物中NaHC03的质量为m,
2NaHCO3
| ||
168 44 18 62
m 19g-15.9g=3.1g
| 168 |
| m |
| 62 |
| 3.1g |
解得:m=8.4g
原混合物中碳酸钠的质量为:19-8.4=10.6g,则其物质的量为0.1mol;
故答案为:0.1;
(3)从0到A发生的反应为Na2CO3+HC1=NaC1+NaHCO3,则A点对应溶液的溶质是NaC1和NaHCO3;
A到C点发生的反应NaHCO3+HC1=NaC1+CO2↑+H2O,
混合物中碳酸钠的物质的量为0.1mol,碳酸氢钠的物质的量为
| 8.4g |
| 84g/mol |
从0到A:Na2CO3 +HC1=NaC1+NaHCO3
0.1mol 0.1mol 0.1mol
从A到C:NaHCO3 +HC1=NaC1+CO2↑+H2O
0.2mol 0.2mol 0.2mol
则C点时消耗盐酸的体积是V=
| 0.3mol |
| 1mol/L |
C点时产生的CO2的体积在标况下是V=nVm=0.2mol×22.4L/mol=4.48L;
故答案为:NaC1、NaHCO3;300;4.48.
点评:本题考查了碳酸钠和碳酸氢钠化学性质及有关计算的问题,结合图象进行分析,增加了题目难度,本题综合性较强,难度中等.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
下列实验设计中,能达到预期目的是( )
| A、将氯化钠和硝酸钾的混合物用溶解、过滤的方法分离 |
| B、将氢气和氧气的混合气体通过灼热的氧化铜除去氢气 |
| C、用碳酸钠溶液区分氯化钠溶液、氯化钡溶液及硝酸钙溶液 |
| D、将氯化钾和二氧化锰的混合物用溶解、过滤、蒸发的方法分离 |
下列有关化学用语表示正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、甲烷分子的比例模型: |
| C、乙酸的结构简式:C2H4O2 |
D、羟基的电子式: |
某元素的离子结构示意图为 ,该元素在周期表中的位置是( )
,该元素在周期表中的位置是( )
 ,该元素在周期表中的位置是( )
,该元素在周期表中的位置是( )| A、第5周期零族 |
| B、第6周期第IB族 |
| C、第5周期第ⅦA族 |
| D、第6周期第IA族 |
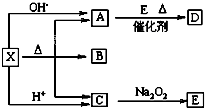 如图是常见物质间的反应关系,其中并且部分产物已被略去.常温下X为固体、B为液态,其余为气体.X受热分解生成A、B、C的物质的量相等.根据图中关系:
如图是常见物质间的反应关系,其中并且部分产物已被略去.常温下X为固体、B为液态,其余为气体.X受热分解生成A、B、C的物质的量相等.根据图中关系: