题目内容
1.电解熔融的氧化铝制取金属铝,若有0.3mol电子发生转移,则理论上能得到金属铝物质的量是多少?分析 根据电子转移守恒计算生成Al的物质的量,再根据m=nM计算Al的质量.
解答 解:电解熔融的氧化铝制取金属铝,反应中Al元素化合价由+3价降低为0价,若有0.3mol电子发生转移,则生成Al的物质的量为$\frac{0.3mol}{3}$=0.1mol,则理论上能得到金属铝物质的量是0.1mol×27g/mol=2.7g,
答:理论上能得到金属铝物质的量是2.7g.
点评 本题考查氧化还原反应计算,比较基础,理解氧化还原反应中电子转移守恒应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4L CHCl3含氯原子数为3NA | |
| B. | 100mL 1 mol•L-1醋酸溶液中的氢原子数为0.4NA | |
| C. | 常温常压下,11.2g乙烯中共用电子对数为2.4NA | |
| D. | 6.4 g CaC2晶体中所含的离子总数为0.3NA |
9.下图所示的四个原电池装置,其中结论正确的是( )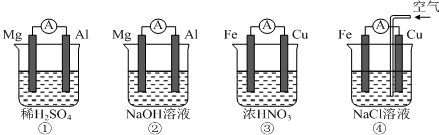

| A. | ①中Mg作负极,电子流向:Mg→稀硫酸→Al | |
| B. | ②中Al作负极,OH?迁移方向:Al→外电路→Mg | |
| C. | ③中Fe作正极,电极反应式:2H++2e?═H2↑ | |
| D. | ④中Cu作正极,电极反应式:O2+4e?+2H2O═4OH? |
16.已知:H2O(g)═H2O(l)△H1=-Q1kJ•mol-1;C2H5OH(g)=C2H5OH(l)△H2=-Q2kJ•mol-1;C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ•mol-1.若23g液体酒精完全燃烧,最后恢复到室温,则放出的热量为( )
| A. | Q1+Q2+Q3 | B. | 1.5Q1-0.5Q2+0.5Q3 | ||
| C. | 0.5Q1-0.5Q2+0.5Q3 | D. | 0.5(Q1+Q2+Q3) |
13.下列开发利用自然资源制取化学品,其途径较合理的是( )
| A. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{电解}{→}$Mg | |
| B. | 石油$\stackrel{裂解}{→}$$\stackrel{分馏}{→}$苯、甲苯、二甲苯、酚等 | |
| C. | 铝土矿$\stackrel{NaOH}{→}$$\stackrel{过滤}{→}$$\stackrel{盐酸}{→}$$\stackrel{过滤}{→}$Al(OH)3$\stackrel{灼烧}{→}$Al2O3$\stackrel{电解}{→}$Al | |
| D. | 海洋生物$\stackrel{灼烧}{→}$$\stackrel{浸取}{→}$$\stackrel{Cl_{2}}{→}$$\stackrel{萃取}{→}$$\stackrel{分离提纯}{→}$I2 |
10.下列排列顺序不正确的是( )
| A. | 原子半径:钠>硫>氯 | |
| B. | 最高价氧化物对应的水化物的酸性:HClO4>H2SO4>H3PO4 | |
| C. | 热稳定性:碘化氢>溴化氢>氯化氢 | |
| D. | 最高正化合价:氯>硫>磷 |
11.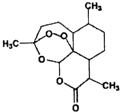 屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )
屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )
 屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )
屠呦呦等科学家用乙醚从青蒿中提取出青蒿素,其结构如图所示,已知结构中含有与H2O2相似的过氧键.下列说法正确的是( )| A. | 青蒿素的结构中含有过氧键受热容易分解 | |
| B. | 乙醚的结构简式为:CH3OCH3 | |
| C. | 青蒿素溶于热水,所以应加热加快溶解 | |
| D. | 乙醚易溶于水,不能用分液的方法分离 |
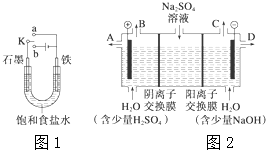 (1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题: