题目内容
20.卢瑟福提出原子的行星模型的实验依据是( )| A. | α粒子散射实验 | B. | 铀盐晶体实验 | C. | X-射线管实验 | D. | 14C放射性实验 |
分析 卢瑟福在成功地进行了α粒子散射实验后,提出了原子核式结构模型,原子的中心有一个原子核,占很小的体积,但其密度很大,几乎集中了原子的全部质量,带负电的电子在不同的轨道上绕原子核运动,据此分析.
解答 解:卢瑟福在成功地进行了α粒子散射实验后,提出了原子核式结构模型,原子的中心有一个原子核,占很小的体积,但其密度很大,几乎集中了原子的全部质量,带负电的电子在不同的轨道上绕原子核运动;卢瑟福提出的原子模型像一个太阳系,带正电的原子核像太阳,带负电的电子像绕着太阳转的行星,原子中带正电的物质集中在一个很小的核心上,而且原子质量的绝大部分也集中在这个很小的核心上;这就是卢瑟福提出的原子的行星模型;
故选A.
点评 本题考查了原子的结构模型,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握原子结构模型的发展过程.

练习册系列答案
相关题目
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 4.6g乙醇含有的C-H键数为0.6NA | |
| B. | 2gD216O含有的质子数和中子数均为NA | |
| C. | 每生成1molO2,转移的电子数一定为4NA | |
| D. | 标准状况下,22.4L NO与11.2L O2充分反应,产物分子数为NA |
8.大量生产金属单质铁和铝的方法是( )
| A. | 加热法和还原法 | B. | 还原法和加热法 | C. | 还原法和电解法 | D. | 电解法和还原法 |
15.X、Y为两种主族元素,其原子的最外层电子数分别为1和6,则X、Y两种元素形成的化合物( )
| A. | 一定是离子化合物 | |
| B. | 一定是共价化合物 | |
| C. | 一定形成X2Y型化合物 | |
| D. | 可能含有离子键、极性键、非极性键中的一种或两种 |
5.已知两瓶气体,分别是HCl和Cl2.可以区别它们的方法或试剂是( )
①观察颜色
②打开瓶盖看有无白雾
③湿润的淀粉试纸
④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸 ⑥硝酸银溶液.
①观察颜色
②打开瓶盖看有无白雾
③湿润的淀粉试纸
④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸 ⑥硝酸银溶液.
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ①②④⑤ | D. | ①②④⑥ |
12.将混有少量泥沙的碘的混合物分离最佳方法是( )
| A. | 将混合物溶于水 | B. | 将混合物加热使碘升华 | ||
| C. | 将混合物倒入NaOH溶液 | D. | 将混合物倒入酒精中充分溶解 |
9.常温时,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 使紫色石蕊试液变红的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HS- |
10.在pH=1的无色溶液中能大量共存的离子组是( )
| A. | Na+、Ca2+、Cl-、HCO3- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+、Mg2+、SO42-、Cl- |
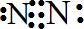 ;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D
;将空气中的氮气转化为氮的化合物的过程称为固氮,下列能实现人工固氮的是D