题目内容
9.常温时,下列各组离子在指定溶液中能大量共存的是( )| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 使紫色石蕊试液变红的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HS- |
分析 A.pH=1的溶液,显酸性;
B.使紫色石蕊试液变红的溶液,显酸性;
C.c(H+)/c(OH-)=1012的溶液,显酸性;
D.由水电离出的c(H+)=1×10-14mol/L的溶液,为酸或碱溶液.
解答 解:A.pH=1的溶液,显酸性,Fe2+、NO3-发生氧化还原反应,不能共存,故A不选;
B.使紫色石蕊试液变红的溶液,显酸性,不能大量存在ClO-,故B不选;
C.c(H+)/c(OH-)=1012的溶液,显酸性,该组离子之间不反应,可大量共存,故C选;
D.由水电离出的c(H+)=1×10-14mol/L的溶液,为酸或碱溶液,酸碱溶液中不能大量存在HS-,故D不选;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
19.下列叙述正确的是( )
| A. | 可能存在核外电子排布式为1s22s22p63s23p64s24p1的原子 | |
| B. | 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反 | |
| C. | 次氯酸的电子式:H?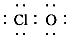 | |
| D. | 基态原子的电子获得一定能量变为激发态原子,而激发态原子变为基态原子,则要放出能量 |
20.卢瑟福提出原子的行星模型的实验依据是( )
| A. | α粒子散射实验 | B. | 铀盐晶体实验 | C. | X-射线管实验 | D. | 14C放射性实验 |
14.下列解释事实的化学(或离子)方程式正确的是( )
| A. | 向100ml浓度均为1mol/LFeI2、FeBr2混合溶液中通入标况下4.48L的氯气:3Cl2+2Fe2++4I-=2I2+2Fe3++6Cl- | |
| B. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ | |
| C. | 在澄清石灰水中加入过量的Ca(HCO3)2溶液:2OH-+Ca2++2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 向NaClO溶液加入少量FeCl2溶液:2Fe2++ClO-+2H+═2Fe3++2H2O+Cl- |
1.下列除杂所选用的试剂(括号内为杂质)及操作方法均正确的一组是( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaOH(Na2CO3) | 盐酸 | - |
| B | CO2(CO) | 氧气 | 加热 |
| C | Cu(Fe) | CuSO4溶液 | 过滤 |
| D | NaCl(Na2SO4) | BaCl2溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
18.下列各组离子在常温下一定能大置共存的是( )
| A. | 在 0.1mol•L-1FeCl3溶液中,K+、Na+、I-、SCN- | |
| B. | 在$\frac{{c({H^+})}}{{c(O{H^-})}}={10^{12}}$的溶液中Al3+、NO3-、K+、Cl- | |
| C. | 1.0mol•L-1KMnO4溶液,H+、Fe2+、Cl-、SO42- | |
| D. | 通入大量 CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
19.下列混合物可用加热方法分离的是( )
| A. | 晶体碘和氯化铵 | B. | 碳酸钙和二氧化锰 | ||
| C. | 硫酸钾和氯酸钾 | D. | 氯化铵和氯化钡 |