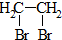题目内容
12. 电解原理在化学工业中有广泛应用.下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)X的电极名称是阴极.
(2)若X、Y都是惰性电极,a是硝酸钠溶液,实验开始时,同时在两边各滴入几滴石蕊试剂,Y极上的电极反应式为2H2O-4e-=4H++O2↑,一段时间后,在X极附近观察到的现象是有气泡,溶液变红.
(3)若X、Y都是惰性电极,a是足量的AgNO3溶液,写出电解过程的化学方程式4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3 ,电解一段时间,当电极上通过的电子为0.2mol时,阴极上生成物的质量为21.5g.
(4)若要用电镀方法在铁表面镀一层金属铜,应该选择的方案是D.
| 方案 | X | Y | a溶液 |
| A | 铜 | 石墨 | CuSO4 |
| B | 铜 | 铁 | CuSO4 |
| C | 铁 | 铜 | Fe(NO3)3 |
| D | 铁 | 铜 | CuSO4 |
分析 (1)电解池中阳极连电源的正极,阴极连接电源的正极;
(2)若X、Y都是惰性电极,a是饱和NaCl溶液,X连接电源负极,为阴极,Y连接电源正极,为阳极.阴极发生还原反应,水在阴极放电生成氢气与氢氧根离子,酚酞遇碱变红色;阳极发生氧化反应,氢氧根离子放电生成氧气;
(3)若X、Y都是惰性电极,a是足量的AgNO3溶液,阴极上银离子获得电子析出Ag,阳极上水电离的氢氧根离子失去电子得到氧气,阳极有硝酸生成;根据电子转移守恒计算阴极析出Ag的质量;
(4)电镀池中导出金属作阳极,镀件作阴极,电镀液含有镀层金属阴离子.
解答 解:(1)X连接电源负极,为阴极,Y连接电源正极,为阳极,故答案为:阴极;
(2)若X、Y都是惰性电极,a是饱和NaCl溶液,X连接电源负极,为阴极,Y连接电源正极,为阳极.阳极发生氧化反应,氢氧根离子放电生成氧气,电极反应式为:2H2O-4e-=4H++O2↑,阴极发生还原反应,水在阴极放电生成氢气与氢氧根离子,电极反应式为:4H2O+4e-═4OH-+2H2↑,反应生成氢气与碱,在X极附近观察到的现象是:有气泡,溶液变红,
故答案为:2H2O-4e-=4H++O2↑;有气泡,溶液变红;
(3)若X、Y都是惰性电极,a是足量的AgNO3溶液,阴极上银离子获得电子析出Ag,阳极上水电离的氢氧根离子失去电子得到氧气,阳极有硝酸生成,电池从反应式为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3 ,电解一段时间,当电极上通过的电子为0.2mol时,阴极上析出0.2mol Ag,析出Ag的质量为0.2mol×108g/mol=21.6g,
故答案为:4AgNO3+2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4HNO3 ;21.6g;
(4)如要用电解方法在铁上镀铜,Fe为阴极、Cu为阳极,电解质溶液含有铜离子,可以是CuSO4溶液等,
故选:D.
点评 本题考查电解原理及应用,根据电解本质是氧化还原反应理解工作原理与离子放电书写,掌握电化学中两极判断方法,难度中等.


| A. | 若I中装过量高锰酸钾溶液,Ⅱ中装澄清石灰水,则能检验SO2中是否混有CO2 | |
| B. | 若I中装足量澄清石灰水,Ⅱ中装浓硫酸,则能测定CO2和水蒸气的混合气体中水蒸气的含量 | |
| C. | 若I中装足量饱和碳酸钠溶液,Ⅱ中装浓硫酸,则能除去CO2中混有的HCl | |
| D. | 若I中装BaCl2溶液,Ⅱ中装水,则能证明SO2和NO2混合气体中SO2不与BaCl2反应 |
| A. | BaCl2溶液 | B. | NaOH饱和溶液 | C. | CuSO4溶液 | D. | 盐酸 |
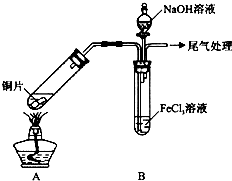
(1)实验前,应先检查装置的气密性;实验中产生的尾气应通人NaOH溶液.
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、100mL容量瓶、胶头滴管.
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是开始无现象,然后产生白色沉淀.
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色.
【查阅资料】Fe(HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-.
Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是Fe3++H2O+Fe(HSO3)2+═2Fe2++SO42-+3H+.
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:
| 步骤② | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程.
| A. | 变小 | B. | 不变 | ||
| C. | 增大 | D. | 可能增大、减小,也可能不变 |
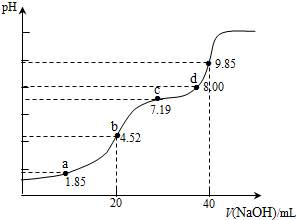
| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(SO32-)=c(HSO3-) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
| A. | NaHCO3能与碱反应,可用作焙制糕点的膨松剂 | |
| B. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| C. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| D. | Fe比Cu活泼,可用FeCl3溶液腐蚀线路板上的Cu |
 呵护生存环境,共建和谐社会是当今社会的主题.
呵护生存环境,共建和谐社会是当今社会的主题.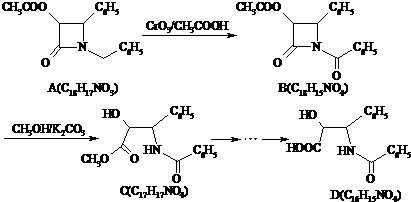
 .
.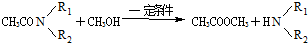
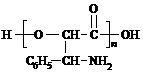 或
或 ;
;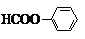 或
或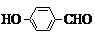 .
.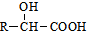 ②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl
②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl