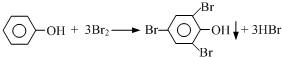
题目内容
8.下列有关电解质溶液中粒子浓度关系不正确的是( )| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)>c(I-) | |
| B. | 含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| C. | CH3COOH溶液中滴加NaOH溶液过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
分析 A.氯化银的溶解度大于碘化银,则氯离子浓度大于碘离子;
B.含等物质的量NaHC2O4和Na2C2O4的溶液中存在物料守恒,2n(Na)=3n(C2O4);
C.CH3COOH溶液中滴加NaOH溶液少量,存在大量醋酸和少量醋酸钠分析;
D.pH=1的NaHSO4溶液中存在电荷守恒和物料守恒分析判断;
解答 解:A.含有AgCl和AgI固体的悬浊液,碘化银的溶解度小于氯化银,则氯离子浓度大于碘离子,溶液中离子浓度大小为:c(Ag+)>c(Cl-)>c(I-),故A正确;
B.含等物质的量NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)],故B错误;
C.CH3COOH溶液中滴加NaOH溶液少量,存在大量醋酸和少量醋酸钠,离子浓度大小为:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故C正确;
D.pH=1的NaHSO4溶液中存在电荷守恒,c(Na+)+c(H+)=2c(SO42-)+c(OH-),物料守恒c(Na+)=c(SO42-)得到c(H+)=c(SO42-)+c(OH-),故D正确;
故选B.
点评 本题考查了离子浓度大小比较、难溶物溶解平衡应用、弱电解质的电离等知识,题目难度中等,试题知识点较多,充分考查了学生的分析、理解能力,注意掌握电荷守恒、物料守恒的含义,明确难溶物溶解平衡及其应用方法.

练习册系列答案
相关题目
16.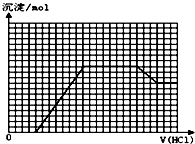 某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示(HCO3-与Al3+和AlO2-均要反应,不共存).下列判断正确的是( )
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示(HCO3-与Al3+和AlO2-均要反应,不共存).下列判断正确的是( )
 某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示(HCO3-与Al3+和AlO2-均要反应,不共存).下列判断正确的是( )
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示(HCO3-与Al3+和AlO2-均要反应,不共存).下列判断正确的是( )| A. | 原溶液中可能含有NH4+、SO42- | |
| B. | 最终溶液中最少含2种溶质 | |
| C. | 原溶液中n(NaAlO2):n(Na2CO3)=1:1 | |
| D. | 滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+═HCO3- |
14.下列反应不能用勒夏特列原理解释的是( )
| A. | 电解水时加入Na2SO4溶液 | |
| B. | 向K2Cr2O7溶液中滴加MaOH溶液后变黄色 | |
| C. | 石灰岩雨水溶蚀形成溶洞 | |
| D. | 用TiCl4与水反应制备TiO2 |
3.下列各组化合物中,不论二者以什么比例混合,只要总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量不变的是( )
| A. | C3H6、C4H4O2 | B. | C3H8、C4H6O | C. | CH4O、C3H4O5 | D. | C2H2、C6H6 |
13.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol羧酸和1mol乙醇,该羧酸的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C16H22O5 | D. | C16H20O5 |
18.下列反应中,属于取代反应的是( )
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 乙醇燃烧 | |
| C. | 丙烷与氯气混合,在光照条件下反应 | |
| D. | 电石与水反应制取乙炔 |