题目内容
3.下列各组化合物中,不论二者以什么比例混合,只要总物质的量一定,则完全燃烧时生成水的质量和消耗O2的质量不变的是( )| A. | C3H6、C4H4O2 | B. | C3H8、C4H6O | C. | CH4O、C3H4O5 | D. | C2H2、C6H6 |
分析 总物质的量一定时有机物完全燃烧时,生成水的质量和消耗O2的质量不变,则化学式中的氢原子个数相同,1mol CxHyOz的耗氧量(x+$\frac{y}{4}$-$\frac{z}{2}$)mol相同即符合题意.
解答 解:A.C3H6和C4H4O2中氢原子个数不相同,不符合题意,故A错误;
B.C3H8、C4H6O中氢原子个数不相同,不符合题意,故B错误;
C.CH4O、C3H4O5中中氢原子个数相同,1mol CH4O的含量为(1+$\frac{4}{4}$-$\frac{1}{2}$)mol=1.5mol,1mol C3H4O5的耗氧量为(3+$\frac{4}{4}$-$\frac{5}{2}$)mol=1.5mol,故C正确;
D.C2H2、C6H6中氢原子个数不相同,不符合题意,故D错误.
故选:C.
点评 本题考查有机物的燃烧计算,注意利用通式法来分析解答,有利于考查学生归纳总结能力,难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
12.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 NaHCO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1CH3COOH溶液等体积混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.10mol•L-1CH3COONa溶液中通入HCl至中性,所得溶液中:c(Na+)>c(CH3COOH)=c(Cl-) |
9.用于合成高吸水性树脂的单体为CH2=CHCOONa.则聚丙烯酸钠中不存在( )
| A. | 离子键 | B. | 极性键 | C. | 非极性键 | D. | 碳碳双键 |
16.把X溶液逐滴滴入Y溶液中,与把Y溶液逐滴滴入X溶液中,所产生的现象相同的是( )
| A | B | C | D | |
| X | HCl | BaCl2 | Na2CO3 | Al2(SO4)3 |
| Y | NaAlO2 | H2SO4 | H2SO4 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
8.下列有关电解质溶液中粒子浓度关系不正确的是( )
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)>c(I-) | |
| B. | 含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| C. | CH3COOH溶液中滴加NaOH溶液过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
12.如表为长式周期表的一部分,其中的编号代表对应的元素.
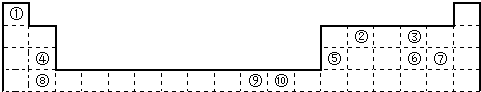
请回答下列问题:
(1)用元素符号表示⑥所在周期(除稀有气体元素外)电负性最大的元素是Cl.
(2)已知元素周期表可按电子排布分为s区、p区等,则⑩元素在ds区.
(3)写出⑩的常见阳离子的最外层电子排布3s23p63d10.
(4)元素⑦基态原子中能量最高的是3p电子,其电子云形状为哑铃形.
(5)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是BD.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp2-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(6)如表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
请回答:表中的金属元素是BEF(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是B元素的np轨道上的电子半充满,自身更稳定,所以第一电离能比A、C大.

请回答下列问题:
(1)用元素符号表示⑥所在周期(除稀有气体元素外)电负性最大的元素是Cl.
(2)已知元素周期表可按电子排布分为s区、p区等,则⑩元素在ds区.
(3)写出⑩的常见阳离子的最外层电子排布3s23p63d10.
(4)元素⑦基态原子中能量最高的是3p电子,其电子云形状为哑铃形.
(5)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是BD.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp2-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(6)如表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
13.下列有机反应的化学方程式书写正确是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. | 2 +Br2$\stackrel{FeBr_{3}}{→}$2 +Br2$\stackrel{FeBr_{3}}{→}$2 | |
| C. | CH3CH2OH+O2$→_{△}^{Cu}$CH3CHO+H2O | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O |