题目内容
20.“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:(1)钠、钾着火,下列可用来灭火的是D.
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)硝酸铵在常温下比较稳定,但在强热的条件下会发生爆炸.可以得到一种无色气体和另一种红棕色的气体等物质,请写出该反应的方程式4NH4NO3=3N2↑+2NO2↑+8H2O;若标况下产生13mol的气体生成,则转移的电子的物质的量为31.2mol.
(3)硝酸铵和碱溶液反应生成的氨气,可以形成氨气--空气燃料电池.其反应原理为NH3+O2→N2+H2O(未配平),则电解质溶液应显碱性(填“酸性”、“中性”或者“碱性”,负极的电极方程式为:2NH3-6e-+6OH-=N2+6H2O.
(4)以TiO2为催化剂,可以用NaClO将CN-离子氧化成CNO-.在酸性条件下,NaCNO继续与NaClO反应生成N2、CO2、NaCl等. 请写出NaCNO在酸性条件下被NaClO氧化的离子方程式2CNO-+3ClO-+2H+=N2↑+2CO2↑+3Cl-+H2O.
分析 (1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气;
(2)硝酸铵在常温下比较稳定,但在强热的条件下会发生爆炸.可以得到一种无色气体是氮气和另一种红棕色的气体是二氧化氮,根据氧化还原反应中得失电子守恒分析解答;
(3)氨气在碱性电解质溶液中稳定存在;燃料电池中,负极是燃料发生失电子的氧化反应;
(4)根据题意可知,酸性条件下CNO-与NaClO反应生成N2、CO2和Cl-,根据氧化还原反应配平.
解答 解:(1)Na、K均与水反应,燃烧生成的过氧化氢均与二氧化碳反应生成氧气,则钠、钾着火,可用细沙盖灭来灭火,故答案为:D;
(2)硝酸铵在常温下比较稳定,但在强热的条件下会发生爆炸.可以得到一种无色气体是氮气和另一种红棕色的气体是二氧化氮,反应方程式为:4NH4NO3=3N2↑+2NO2↑+8H2O,由方程式可知生成5mol的气体转移12mol的电子,若标况下产生13mol的气体生成,转移电子数为$\frac{13}{5}×12$=31.2mol,
故答案为:4NH4NO3=3N2↑+2NO2↑+8H2O;31.2mol;
(3)氨气在碱性电解质溶液中稳定存在;燃料电池中,负极是燃料发生失电子的氧化反应,所以氨作为燃料电池燃气时,负极上是氨气失电子的过程,
即2NH3-6e-+6OH-=N2+6H2O,故答案为:碱性; 2NH3-6e-+6OH-=N2+6H2O;
(4)酸性条件下CNO-与NaClO反应生成N2、CO2和Cl-,反应离子方程式为2 CNO-+3ClO-+2H+=N2↑+2CO2↑+3Cl-+H2O,
故答案为:2 CNO-+3ClO-+2H+=N2↑+2CO2↑+3Cl-+H2O.
点评 本题考查氧化还原反应的计算,综合性较强,注重高频考点的考查,侧重分析与计算能力的考查,注意反应中元素的化合价变化,题目难度中等.

| A. | 离子键 | B. | 极性键 | C. | 非极性键 | D. | 碳碳双键 |
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)>c(I-) | |
| B. | 含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| C. | CH3COOH溶液中滴加NaOH溶液过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
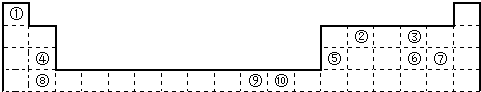
请回答下列问题:
(1)用元素符号表示⑥所在周期(除稀有气体元素外)电负性最大的元素是Cl.
(2)已知元素周期表可按电子排布分为s区、p区等,则⑩元素在ds区.
(3)写出⑩的常见阳离子的最外层电子排布3s23p63d10.
(4)元素⑦基态原子中能量最高的是3p电子,其电子云形状为哑铃形.
(5)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是BD.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp2-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(6)如表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
| A. | 副族元素没有非金属元素 | |
| B. | 除短周期外,其他周期均为18种元素 | |
| C. | 同周期相邻的第ⅡA族和第ⅢA族的元素,原子序数只相差1 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
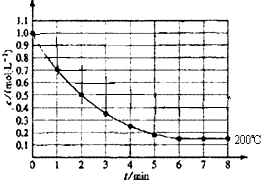 在一密闭容器中放入1molX(g)发生反应:X(g)?4Y(g)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
在一密闭容器中放入1molX(g)发生反应:X(g)?4Y(g)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.