题目内容
17.如图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略)
(1)A、B、C、D代表的物质分别为Al、C、H2O、Na2O2(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是2H2O+2Na2O2=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)反应②中,若B与F物质的量之比为4:3,G、H分别是CO2、CO(填化学式);
(4)反应③的化学方程式为Na2CO3;
(5)反应④的离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
分析 题干信息,A为常见的金属单质,B为非金属单质(一般是黑色粉末)推断为C,C是常见的无色无味液体可以推断为H2O,D是淡黄色的固体化合物判断为Na2O2,E、F为O2和H2的反应生成水,A是常见金属,与另一种固体在水中反应生成O2和H2,则该固体金属为Al,固体D为Na2O2,能与水和CO2反应,则G为CO2;说明K为Na2CO3,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳),C和O2反应可生成CO2和CO,则H为CO;依据F(O2)与E反应生成C(水)可知E为氢气,结合物质的性质解答该题.
解答 题干信息,A为常见的金属单质,B为非金属单质(一般是黑色粉末)推断为C,C是常见的无色无味液体可以推断为H2O,D是淡黄色的固体化合物判断为Na2O2,E、F为O2和H2的反应生成水,A是常见金属,与另一种固体在水中反应生成O2和H2,则该固体金属为Al,固体D为Na2O2,能与水和CO2反应,则G为CO2;说明K为Na2CO3,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳),C和O2反应可生成CO2和CO,则H为CO;依据F(O2)与E反应生成C(水)可知E为氢气;推断可知A为Al,B为C,C为H2O,D为Na2O2,E为H2,F为O2,G为CO2,H为CO,K为Na2CO3,
(1)依据推断可知,A、B、C、D代表的物质分别为:Al、C、H2O、Na2O2,
故答案为:Al;C;H2O;Na2O2;
(2)反应①中的C、D均过量,生成的氢氧化钠溶液能和A完全反应,该反应的化学方程式是:2H2O+2Na2O2=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2H2O+2Na2O2=4NaOH+O2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)依据反应C+O2=CO2:n(C):n(O2)=1:1,发生反应产物为二氧化碳;依据反应2C+O2=2CO;n(C):n(O2)=2:1,发生反应生成一氧化碳气体;反应②中,若B(C)与F(O2)物质的量之比为4:3,1:1<n(C):n(O2)=4:3<2:1;判断G、H分别是:CO2、CO,
故答案为:CO2;CO;
(4)反应③是过氧化钠和二氧化碳气体的反应生成碳酸钠和氧气,F为氧气,产物中K为碳酸钠,化学式为:Na2CO3,故答案为:Na2CO3;
(5)分析判断G为CO2,溶液乙是碳酸钠溶液,G+溶液甲=溶液乙+沉淀L,所以甲溶液中的偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,反应④的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
点评 本题考查了物质转化关系的综合应用,物质性质的分析判断,转化关系的定量计算和产物判断,离子方程式的书写方法,转化关系的特征反应是解题的关键,题目难度较大.

| A. | 实验室盛放碳酸钠溶液的试剂瓶不能用玻璃塞 | |
| B. | 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将两者混合就可产生大量二氧化碳的泡沫 | |
| C. | 用氯化铵溶液除去铁锈 | |
| D. | 可用碳酸钠与醋酸制取少量二氧化碳 |
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)>c(I-) | |
| B. | 含等物质的量NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| C. | CH3COOH溶液中滴加NaOH溶液过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
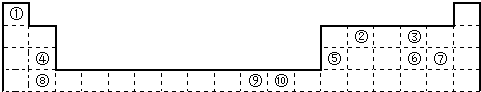
请回答下列问题:
(1)用元素符号表示⑥所在周期(除稀有气体元素外)电负性最大的元素是Cl.
(2)已知元素周期表可按电子排布分为s区、p区等,则⑩元素在ds区.
(3)写出⑩的常见阳离子的最外层电子排布3s23p63d10.
(4)元素⑦基态原子中能量最高的是3p电子,其电子云形状为哑铃形.
(5)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志.有关该氢化物分子的说法正确的是BD.
A.分子中含有分子间的氢键 B.属于含有极性键的非极性分子
C.只含有4个sp2-s的σ键和1个p-p的π键 D.该氢化物分子中②原子采用sp2杂化
(6)如表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据.
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
| A. | 副族元素没有非金属元素 | |
| B. | 除短周期外,其他周期均为18种元素 | |
| C. | 同周期相邻的第ⅡA族和第ⅢA族的元素,原子序数只相差1 | |
| D. | 核外电子排布相同的微粒化学性质也相同 |
| A. | 化合物乙中只有共价键 | |
| B. | 甲可与Z和X形成的某种化合物反应生成强酸 | |
| C. | W的氧化物只能与碱反应,不能与任何酸反应 | |
| D. | X分别与Y、Z、G、W形成的气态化合物中,稳定性最好的是XG |
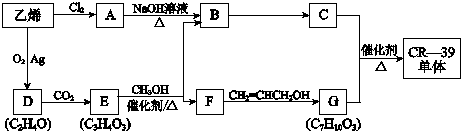
已知:i.CR-39单体结构简式是:
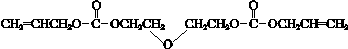
ii.酯与醇有如下反应:
RCOOR′+R″OH$→_{△}^{催化剂}$RCOOR″+R′OH(R、R′、R″代表烃基)
(1)乙烯转化为A的反应类型是加成反应.
(2)在D、E的分子中,都只有一种化学环境的氢原子.
①D的结构简式是
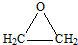 .
.②E为五元环状化合物,E与CH3OH反应的化学方程式是
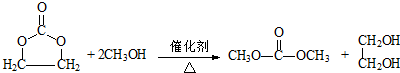 .
.(3)G与足量NaOH溶液反应的化学方程式是
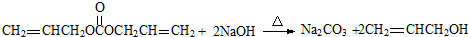 .
.(4)F的一种同分异构体K,其分子中不同化学环境的氢原子个数比是3:1:1:1,且能与NaHCO3反应.
①K能发生消去反应,生成的有机物的结构简式是
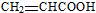 .
.②K在一定条件下合成高分子化合物的化学方程式是
 .
.(5)下列有关C的叙述正确的是(填写序号)acd.
| a.能与乙酸发生酯化反应 | b.能与乙醇发生酯化反应 |
| c.1mol C最多能与2mol Na反应 | d.C的同分异构体不能发生银镜反应 |
 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:

 ;检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.
;检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.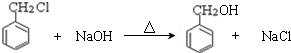 .
. .
.