题目内容
12.如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是( )有关数据如表所示:
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |

| A. | 该电池的正极反应式为MnO2+eˉ+H+═MnOOH | |
| B. | 利用干电池,高温电解H2O-CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1 | |
| C. | 废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离 | |
| D. | 废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法 |
分析 A.正极上MnO2得电子生成MnOOH;
B.阳极上失电子生成氧气,阴极上得电子生成H2和CO;
C.氯化锌的溶解度比氯化铵受温度的影响大;
D.在空气中加热碳粉会转化为二氧化碳,MnOOH分解生成二氧化锰.
解答 解:A.正极上MnO2得电子生成MnOOH,则该电池的正极反应式为MnO2+e-+H+═MnOOH,故A正确;
B.阳极上失电子生成氧气,阴极上得电子生成H2和CO,电解方程式为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,则阴、阳两极生成的气体的物质的量之比是2:1,故B错误;
C.氯化锌的溶解度比氯化铵受温度的影响大,能通过重结晶方法分离,故C正确;
D.在空气中加热碳粉会转化为二氧化碳,MnOOH分解生成二氧化锰,所以加热法可以除去二氧化锰、碳粉和MnOOH中的碳粉和MnOOH,故D正确.
故选B.
点评 本题考查了原电池原理和电解池原理的应用、物质的分离提纯等,题目难度中等,注意把握原电池和电解池中电极上发生的反应以及物质分离提纯的方法.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 中和滴定实验时,用待测液润洗锥形瓶 | |
| B. | 用带玻璃塞的磨口瓶盛放NaOH溶液 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 | |
| D. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 |
20.将盛有N2和NO2(无N2O4 )混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N2和NO2的体积比是( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
17.下列关于教材中的各项知识的说法或做法不正确的是( )
| A. | 漂白粉既可做漂白棉麻纸张的溧白剂,又可做游泳池及环境的消毒剂 | |
| B. | 氮肥包括铵态氮肥、硝态氮肥和尿素 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 硅胶可用作食品干燥剂 |
4.甲与乙在敞口容器里的溶液中的转化关系如图所示,甲不可能是( )
甲$\stackrel{OH-}{→}$乙$\stackrel{H+}{→}$甲.
甲$\stackrel{OH-}{→}$乙$\stackrel{H+}{→}$甲.
| A. | Fe2+ | B. | Al | C. | HCO${\;}_{3}^{-}$ | D. | CO2 |
2.(1)CO2和CH4是两种重要的温室气体,通过CH4和CO2的反应,制造更高价值的化学品是目前的研究目标.250℃时,以镍合金为催化剂,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g)
①此温度下该反应的平衡常数表达式K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1kJ•mol-1;
(2)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
①根据表中数据可判断△H<0 (填“>”、“=”或“<”).
②300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
①此温度下该反应的平衡常数表达式K=$\frac{c(CO)^{2}×c({H}_{2})^{2}}{c(C{O}_{2})×c(C{H}_{4})}$.
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1kJ•mol-1;
(2)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g)△H,
下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②300℃时,将2molCO、3molH2和2molCH3OH充入容积为1L的密闭容器中,此时反应将A.
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
③下列能说明上述反应达到化学平衡状态的标志是C
A.恒温恒容下,混合气体的密度不在变化
B.达平衡时,v(CO):v(H2):v(CH3OH)=1:2:1
C.达平衡时,CH3OH浓度不再变化
D.单位时间内生产nmolCO同时生成2nmolH2.
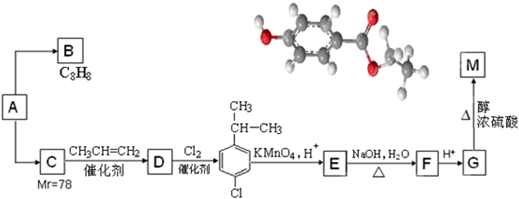
 .
. .
. (任意一种).
(任意一种).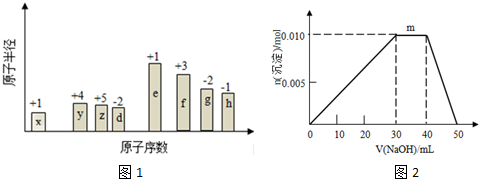
 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是2NaOH+(CN)2=NaCN+NaCNO+H2O. .
.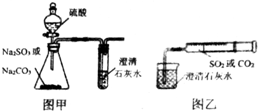 某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.
某同学用图甲所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象.经过思考分析,该同学改用图乙的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快.