题目内容
17.下列关于教材中的各项知识的说法或做法不正确的是( )| A. | 漂白粉既可做漂白棉麻纸张的溧白剂,又可做游泳池及环境的消毒剂 | |
| B. | 氮肥包括铵态氮肥、硝态氮肥和尿素 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 硅胶可用作食品干燥剂 |
分析 A.漂白粉具有强氧化性;
B.一般含N元素的无机盐常作氮肥;
C.NaOH为强碱,酸碱反应放出大量的热;
D.硅胶具有吸水性.
解答 解:A.漂白粉具有强氧化性,则可做漂白棉麻纸张的溧白剂,又可做游泳池及环境的消毒剂,故A正确;
B.一般含N元素的无机盐常作氮肥,则氮肥包括铵态氮肥、硝态氮肥和尿素,只有尿素为有机物,故B正确;
C.NaOH为强碱,酸碱反应放出大量的热,则浓硫酸溅到皮肤上时,先用布擦,再用大量水冲洗,最后涂上适量碳酸氢钠溶液,故C错误;
D.硅胶具有吸水性,则可用作食品干燥剂,故D正确;
故选C.
点评 本题考查物质的性质与用途,为高频考点,把握物质的性质、发生的反应及性质与用途的关系是解本题关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡.
(1)氨水是中学常见碱
①下列事实可证明氨水是弱碱的是BD(填字母序号).
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1mol•L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1mol•L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.

①滴定醋酸的曲线是I(填“I”或“II”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol•L-1醋酸溶液.
③V1和V2的关系:V1<V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验.
已知:ⅠAgSCN是白色沉淀.
Ⅱ相同温度下,Ksp(AgI)=8.3×10?17,Ksp (AgSCN )=1.0×10?12.
①步骤3中现象a是出现白色沉淀.
②用沉淀溶解平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgSCN>AgI.Ag+与I-反应生成AgI黄色沉淀,AgSCN的溶解平衡正向移动.
③向50mL 0.005mol•L?1的AgNO3溶液中加入150mL0.005mol•L?1的 KSCN溶液,混合后溶液中Ag+的浓度约为4×10?10mol•L?1.(忽略溶液体积变化)
(1)氨水是中学常见碱
①下列事实可证明氨水是弱碱的是BD(填字母序号).
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.常温下,0.1mol•L-1氨水pH为11
C.铵盐受热易分解
D.常温下,0.1mol•L-1氯化铵溶液的pH为5
②下列方法中,可以使氨水电离程度增大的是BC(填字母序号).
A.通入氨气 B.加入少量氯化铁固体
C.加水稀释 D.加入少量氯化铵固体
(2)盐酸和醋酸是中学常见酸
用0.1mol•L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.

①滴定醋酸的曲线是I(填“I”或“II”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol•L-1醋酸溶液.
③V1和V2的关系:V1<V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验.
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1Fe(NO3)3溶液. | 溶液变为红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴 3mol•L-1AgNO3溶液. | 现象a出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴 3mol•L-1KI溶液. | 出现黄色沉淀. |
Ⅱ相同温度下,Ksp(AgI)=8.3×10?17,Ksp (AgSCN )=1.0×10?12.
①步骤3中现象a是出现白色沉淀.
②用沉淀溶解平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgSCN>AgI.Ag+与I-反应生成AgI黄色沉淀,AgSCN的溶解平衡正向移动.
③向50mL 0.005mol•L?1的AgNO3溶液中加入150mL0.005mol•L?1的 KSCN溶液,混合后溶液中Ag+的浓度约为4×10?10mol•L?1.(忽略溶液体积变化)
8.已知草酸为二元弱酸:常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )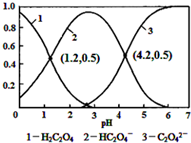

| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×c(C2O42-)=1000 | |
| C. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2 | |
| D. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一定增大 |
5.对可逆反应2A(s)+3B(g)?C(g)+2D(g)△H<0,在一定条件下达到平衡,下列有关叙述正确的组合是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动
③压强增大,平衡不移动
④加入催化剂,B的转化率提高.
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动
③压强增大,平衡不移动
④加入催化剂,B的转化率提高.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
12.如图a酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是由碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,下列说法不正确的是( )
有关数据如表所示:

有关数据如表所示:
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |

| A. | 该电池的正极反应式为MnO2+eˉ+H+═MnOOH | |
| B. | 利用干电池,高温电解H2O-CO2混合气体制备H2和CO,如图b,则阴、阳两极生成的气体的物质的量之比是1:1 | |
| C. | 废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过重结晶方法分离 | |
| D. | 废电池糊状填充物加水处理后所得滤渣的主要成分是二氧化锰、碳粉和MnOOH,欲从中得到较纯的二氧化锰,可以采用加热的方法 |
7.硅是带来人类文明的重要元素之一,下列物质中主要成分是硅酸盐的是( )
| A. | 金刚石 | B. | 砖瓦 | C. | 水晶 | D. | 大理石 |