题目内容
能正确表示下列反应的离子方程式是( )
| A、FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+ |
| B、过量的二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=HCO3-+Al(OH)3↓ |
| C、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
| D、用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
考点:离子方程式的书写
专题:
分析:A.电荷不守恒;
B.过量的二氧化碳通入偏铝酸钠溶液中反应生成碳酸氢钠和氢氧化铝;
C.不符合反应的客观事实;
D.得失电子不守恒.
B.过量的二氧化碳通入偏铝酸钠溶液中反应生成碳酸氢钠和氢氧化铝;
C.不符合反应的客观事实;
D.得失电子不守恒.
解答:
解:A.FeCl3溶液与Cu的反应,离子方程式:Cu+2Fe3+=Cu2++2Fe2+,故A错误;
B.过量的二氧化碳通入偏铝酸钠溶液中,离子方程式:CO2+2H2O+AlO2-=HCO3-+Al(OH)3↓,故B正确;
C.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O,故C错误;
D.用稀硝酸洗涤试管内壁的银镜,离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O,故D错误;
故选:B.
B.过量的二氧化碳通入偏铝酸钠溶液中,离子方程式:CO2+2H2O+AlO2-=HCO3-+Al(OH)3↓,故B正确;
C.用KIO3氧化酸性溶液中的KI:5I-+IO3-+6H+=3I2+3H2O,故C错误;
D.用稀硝酸洗涤试管内壁的银镜,离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O,故D错误;
故选:B.
点评:本题考查离子方程式的书写,明确反应的实质是解题关键,注意反应应符合客观事实,应遵循电荷守恒、原子个数守恒定律.

练习册系列答案
相关题目
下列有关离子方程式与所述事实相符且正确的是( )
A、用惰性电极电解MgCl2溶液:2Cl-+2H2O
| ||||
| B、向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2 | ||||
| D、C12通入澄清石灰水中:C12+2OH-=C1-+CIO-+H2O |
我国科学家在世界上首次合成了三种新核素,其中一种新核素是185Hf(铪).关于185Hf的下列说法中,正确的是( )
| A、是一种新元素 |
| B、原子核内有185个质子 |
| C、原子核内有185个中子 |
| D、是183Hf的一种新的同位素 |
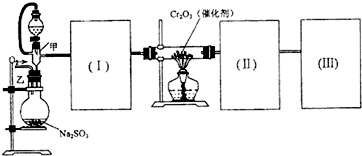
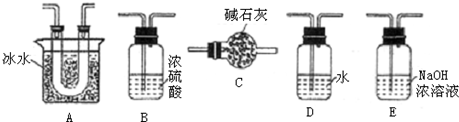
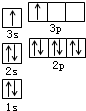 A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题:
A、B、C、D、E都是周期表中前四周期的元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素.请回答下列问题: