题目内容
8.“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分与漂白液中的有效成分相同,这种物质是( )| A. | KMnO4 | B. | NaClO | C. | Ca(ClO)2 | D. | HNO3 |
分析 该消毒液无色,有漂白作用,应为次氯酸钠,氯气与NaOH反应可制备“84”消毒液,以此来解答.
解答 解:氯气与NaOH反应制备漂白液,含次氯酸钠的溶液为无色,且具有漂白性,符合题意;
高锰酸钾溶液为紫色,具有漂白性,Ca(ClO)2为漂白粉的成分,而硝酸不能作漂白剂使用
故选B.
点评 本题考查次氯酸盐的漂白性,为高频考点,把握常见物质的氧化性、颜色为解答的关键,注意“84”消毒液的制备,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列溶液中,微粒的浓度关系正确的是( )
| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c (CH3COO-)>c(H+)>c(OH-) | |
| B. | 等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F-)+c(HF) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | c(NH4+)相等的(NH4)2CO3、(NH4)2SO4、(NH4)2Fe(SO4)2三份溶液,其c依次增大 |
19.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)10种元素中,化学性质最不活泼的是Ar;
(2)②和⑧形成的化合物灼烧时焰色为紫色;
(3)元素⑦的氢化物常温下和元素②的单质反应的离子方程式是2K+2H2O═2K++2OH-+H2↑,用元素⑧的单质制备漂白液的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(4)②③④中形成的简单离子半径由大到小的顺序是K+>Ca2+>Mg2+;
(5)写出①和⑦形成的稳定化合物的电子式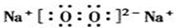 ;
;
(6)用电子式表示⑥和⑦形成化合物的形成过程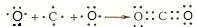 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ||||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
(2)②和⑧形成的化合物灼烧时焰色为紫色;
(3)元素⑦的氢化物常温下和元素②的单质反应的离子方程式是2K+2H2O═2K++2OH-+H2↑,用元素⑧的单质制备漂白液的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(4)②③④中形成的简单离子半径由大到小的顺序是K+>Ca2+>Mg2+;
(5)写出①和⑦形成的稳定化合物的电子式
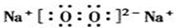 ;
;(6)用电子式表示⑥和⑦形成化合物的形成过程
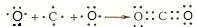 .
.
16.下列说法正确的是( )
| A. | 向CH3CH2Br中滴入AgNO3溶液以检验溴元素 | |
| B. | 检验某卤代烃中是否含溴:加入NaOH溶液,加热,冷却,再加入硝酸银溶液 | |
| C. | 苯不能与溴水发生取代反应,用苯能萃取溴的四氯化碳溶液中的溴 | |
| D. | 利用核磁共振氢谱,可以鉴别CH3OCH3和CH3CH2OH |
3.下列各组离子在指定的溶液中能大量共存的是( )
| A. | 透明的溶液中:Al3+、Cu2+、SO42-、NO3- | |
| B. | 通入SO2的溶液中:Fe3+、Ba2+、Cl-、NO3- | |
| C. | 加入铝粉产生H2的溶液中:NH4+、Fe3+、SO42-、NO3- | |
| D. | 常温下,由水电离出的c(H+)=1×10-12mol/L:K+、Ba2+、Cl-、NO3- |
13.过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸.某实验小组拟探究CaO2的性质及其实验室制法.
(1)实验探究CaO2与酸的反应.
①CaO2与盐酸反应的化学方程式为2CaO2+4HCl═2CaCl2+2H2O+O2↑.
②加入石蕊后溶液褪色可能是因为溶液a中存在较多的H2O2.
(2)用如图1所示装置制备过氧化钙,其反应原理为Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$ CaO2
①请选择实验所需的装置,按气流方向连接的顺序为d→e→f→b→c→c(或d→e→f→c→b→c)(填仪器接口的字母,上述装置可不选用也可重复使用).
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞(填操作);Ⅳ拆除装置,取出产物.
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图2所示.
①NH3在Ca2+和 H2O2的反应过程中所起的作用是中和生成的氢离子,促进反应进行.
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2•8H2O,过滤所需要的玻璃仪器是烧杯、漏斗、玻璃棒;将沉淀进行洗涤的操作为沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次.
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:在FeCl2溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强.
(1)实验探究CaO2与酸的反应.
操作 | 现象 |
| 向盛有4g CaO2的大试管中加入10mL稀盐酸的溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5mL溶液a于试管中,滴入两滴石蕊 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
②加入石蕊后溶液褪色可能是因为溶液a中存在较多的H2O2.
(2)用如图1所示装置制备过氧化钙,其反应原理为Ca+O2$\frac{\underline{\;\;△\;\;}}{\;}$ CaO2

①请选择实验所需的装置,按气流方向连接的顺序为d→e→f→b→c→c(或d→e→f→c→b→c)(填仪器接口的字母,上述装置可不选用也可重复使用).
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞(填操作);Ⅳ拆除装置,取出产物.
(3)利用反应Ca2++H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图2所示.
①NH3在Ca2+和 H2O2的反应过程中所起的作用是中和生成的氢离子,促进反应进行.
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2•8H2O,过滤所需要的玻璃仪器是烧杯、漏斗、玻璃棒;将沉淀进行洗涤的操作为沿玻璃棒向漏斗中注入蒸馏水至浸没沉淀,让水自然流下,重复2-3次.
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:在FeCl2溶液中滴加KSCN溶液,溶液不显红色,再加入少量CaO2粉末,溶液变红色,说明CaO2的氧化性比FeCl3的氧化性强.
20.下列有关氧元素及其化合物表示正确的是( )
| A. | 质子数为8、中子数为10的氧原子:${\;}_{16}^{8}$O | |
| B. | 过氧化氢的电子式: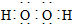 | |
| C. | 氧原子的价电子排布图: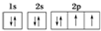 | |
| D. | 次氯酸的结构式:H-Cl-O |
17.乙醇分子中的化学键如图所示:
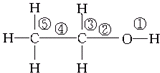
关于乙醇在各种不同反应中断裂键的说法不正确的是( )

关于乙醇在各种不同反应中断裂键的说法不正确的是( )
| A. | 与金属钠反应,键①断裂 | |
| B. | 在Ag或Cu催化作用下和O2反应,键②和键③断裂 | |
| C. | 和浓硫酸共热,在170℃时发生消去反应时键②和⑤断裂 | |
| D. | 乙醇和乙酸在浓硫酸作用下加热时发生反应,键①断裂 |
18.下列关于苯的性质的说法中,正确的是( )
| A. | 苯不溶于水,密度比水大 | |
| B. | 苯在空气中燃烧产生大量的黑烟 | |
| C. | 苯与溴水能发生加成反应生成溴苯 | |
| D. | 苯分子中存在碳碳双键,故能使酸性KMnO4溶液褪色 |