题目内容
5.下列说法正确的是( )| A. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| B. | 若 2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. |  如图可表示水分解过程中的能量变化 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ |
分析 A.放热反应也需要一定引发条件才能发生,吸热反应常温下也可以反应;
B.燃烧热是1mol纯净的可燃物完全燃烧生成稳定氧化物放出的热量;
C.水分解是吸热反应,催化剂降低反应的活化能,加快反应速率;
D.依据焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算,断裂化学键吸热过程.
解答 解:A.需要加热发生的反应不一定是吸热反应,好多放热反应也需要加热如铝热反应,吸热反应不需要条件,常温下也可以反应,如Ba(OH)2•8H2O和NH4Cl反应是吸热反应常温下进行,故A错误;
B.反应生成的是一氧化碳是不稳定的氧化物,不符合燃烧热概念,故B错误;
C.反应物能量低于生成物能量,催化剂降低反应的活化能,加快反应速率,但不改变反应热,图象符合要求,故C正确;
D.、△H=bKJ/mol+cKJ/mol-2H-Cl键能=-aKJ/mol;所以H-Cl键能=$\frac{a+b+c}{2}$KJ/mol;断开1 mol H-Cl键所需吸收的能量为$\frac{a+b+c}{2}$kJ,故D错误;
故选C.
点评 本题考查反应热、燃烧热概念的理解应用,反应放热吸热的判断依据,键能计算焓变的方法应用,题目难度中等.

练习册系列答案
相关题目
15.己知lg2=0.3,lg5=0.7,某温度(t℃)时,测得0.0lmol/L的NaOH溶液的pH=11.在此温度下,将60mLpH=1的H2SO4溶液与40mL0.1mol/L的Ba(OH)2溶液混合(忽略溶液混合体积的变化),所得溶液的pH为( )
| A. | 12.3 | B. | 11.7 | C. | 11.3 | D. | 12.7 |
16.下述实验能达到预期目的是( )
| A. | 将SO2通入酸性KMnO4 溶液中,紫色褪去 证明SO2具有漂白性 | |
| B. | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液后红色褪去 证明Na2CO3溶液中存在水解平衡 | |
| C. | 向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L的FeCl3溶液,又生成红褐色沉淀 证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度 | |
| D. | 测定等物质的量浓度的HCl与H2S溶液的pH,后者较大 证明非金属性Cl>S |
20.下列属于电解质的是( )
| A. | 酒精 | B. | CO2 | C. | 盐酸 | D. | NaOH |
10.通常情况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
| A. | 分子中键角小于109.5.是因为氮原子轨道杂化类型为sp2杂化 | |
| B. | 分子中的所有原子均达到8电子稳定结构 | |
| C. | NCl3分子是非极性分子 | |
| D. | NBr3 比NCl3易挥发 |
17.下列反应属于吸热反应的是( )
| A. | 钠与水反应 | B. | 碳与二氧化碳高温反应 | ||
| C. | 盐酸与氢氧化钠溶液反应 | D. | 甲烷在空气中燃烧 |
16.“绿色奥运”是2008北京奥运会的主题之一.为减轻污染,北京为汽车加装了“三效催化净化器”,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的无毒混合气体,该无毒混合气体是( )
| A. | 二氧化碳和氮气 | B. | 二氧化碳和二氧化氮 | ||
| C. | 二氧化碳和氧气 | D. | 氮气和氧气 |
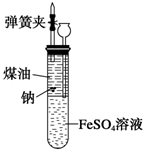 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入用煮过的蒸馏水配制的FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图).仔细观察,回答下列问题:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入用煮过的蒸馏水配制的FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图).仔细观察,回答下列问题: