题目内容
15.己知lg2=0.3,lg5=0.7,某温度(t℃)时,测得0.0lmol/L的NaOH溶液的pH=11.在此温度下,将60mLpH=1的H2SO4溶液与40mL0.1mol/L的Ba(OH)2溶液混合(忽略溶液混合体积的变化),所得溶液的pH为( )| A. | 12.3 | B. | 11.7 | C. | 11.3 | D. | 12.7 |
分析 某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,据此计算离子积常数,将60mLpH=1的H2SO4溶液与40mL0.1mol/L的Ba(OH)2溶液混合后,碱过量,根据c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$求出氢氧根的物质的量浓度,然后根据c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$来计算.
解答 解:某温度(t℃)时,测得0.01mol•L-1的NaOH溶液的pH=11,故此温度下离子积常数Kw=0.01mol/L×10-11mol/L=10-13(mol/L).将60mLpH=1的H2SO4溶液中n(H+)=0.1mol/L×0.06L=0.006mol,40mL0.1mol/L的Ba(OH)2溶液中n(OH-)=0.2mol/L×0.04L=0.008mol,两者混合后碱过量,混合物后溶液中的c(OH-)=$\frac{n(O{H}^{-})-n({H}^{+})}{{V}_{混}}$=$\frac{0.008mol-0.006mol}{0.1L}$=0.02mol/L,故c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-13}}{0.02}$=5×10-12mol/L.故pH=-lg(5×10-12)=12-lg5=11.3.
故选C.
点评 本题考查酸碱混合的计算,题目难度中等,明确该温度下的Kw及pH与浓度的换算是解答本题的关键.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
5.用如图所示装置能达到有关实验目的是( )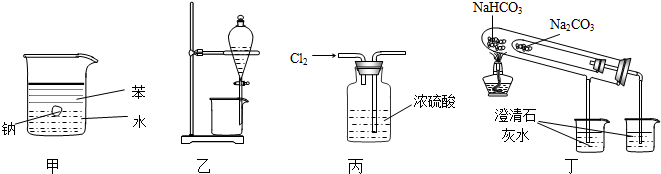

| A. | 用甲图装置证明密度ρ(苯)<ρ(钠)<ρ(水) | |
| B. | 用乙图装置分离酒精和四氯化碳 | |
| C. | 用丙图装置干燥Cl2 | |
| D. | 用丁图装置比较NaHCO3和Na2CO3的热稳定性 |
6.下列解释事实的离子方程式正确的是( )
| A. | 明矾做净水剂:Al3++3H2O═Al (OH)3↓+3H+ | |
| B. | 小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 漂白液加白醋,提高漂白效率:CH3COOH+ClO-═HClO+CH3COO- | |
| D. | 酸化的淀粉碘化钾溶液在空气中放置一段时间变蓝:4I-+O2+2H2O═2I2+4OH- |
10.反应N2(g)+O2(g)?2NO(g)在密闭容器中进行,下列条件不能改变该反应的速率的是( )
| A. | 缩小体积使压强增大 | B. | 体积不变充入N2使压强增大 | ||
| C. | 体积不变充入氦气使压强增大 | D. | 压强不变充入N2使体积增大 |
20.“纳米材料”是指研究、开发出的材料的直径从几纳米至几十纳米.如将纳米材料分散到液体分散剂中所得混合物可能具有的性质是( )
| A. | 能全部透过半透膜 | B. | 有丁达尔现象 | ||
| C. | 所得物质属于纯净物 | D. | 所得物质一定是浊液 |
7.下列物质与常用危险化学品的分类不对应的是( )
| A. | Na--遇湿易燃物品 | B. | Na2O2-是氧化剂 | ||
| C. | 浓硫酸-易爆品 | D. | KOH-腐蚀品 |
4.下列属于物理变化的是( )
| A. | 铁棒锈蚀 | B. | 食物变质 | C. | 滴水成冰 | D. | 光合作用 |
5.下列说法正确的是( )
| A. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| B. | 若 2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. |  如图可表示水分解过程中的能量变化 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ |