题目内容
13.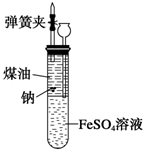 有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入用煮过的蒸馏水配制的FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图).仔细观察,回答下列问题:
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质.实验时,往100mL大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入用煮过的蒸馏水配制的FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图).仔细观察,回答下列问题:(1)有关钠反应的现象是有气泡生成,钠熔化成小球且在煤油和FeSO4溶液界面处上下跳动,最终完全溶解.
(2)大试管的溶液中出现的现象:下层溶液出现白色絮状沉淀.
(3)装置中液面的变化:大试管内下降;长颈漏斗内上升.
(4)写出钠与硫酸亚铁溶液反应的化学方程式:2Na+FeSO4+2H2O═Fe(OH)2↓+Na2SO4+H2↑.
分析 钠的密度大于煤油的密度且和煤油不反应,所以钠在煤油中逐渐下沉;钠的密度小于水的密度,所以在水中会浮在水面上,钠的熔点较低,所以钠在水中会熔成小球;钠和FeSO4溶液中溶剂反应生成氢气,所以生成的氢气推动钠上浮至煤油层;当氢气溢出,钠又回落至界面与FeSO4溶液中溶剂反应,如此反复多次,最后完全消失,由此分析解答.
解答 解:(1)钠的密度大于煤油的密度且和煤油不反应,所以钠在煤油中逐渐下沉;钠的密度小于水的密度,所以在水中会浮在水面上,钠的熔点较低,所以钠在水中会熔成小球;钠和FeSO4溶液中溶剂反应生成氢气,所以生成的氢气推动钠上浮至煤油层;故答案为:有气泡生成,钠熔化成小球且在煤油和FeSO4溶液界面处上下跳动,最终完全溶解;
(2)氢氧化钠与硫酸铁反应生成白色的沉淀,故答案为:下层溶液出现白色絮状沉淀;
(3)该反应中有氢气生成,所以大试管内气体的压强增大,大于外界大气压,导致大试管内的溶液下降,把试管内的溶液压入长颈漏斗中,所以长颈漏斗中液面逐渐上升,
故答案为:下降;上升;
(4)钠与硫酸亚铁溶液反应,是钠与水反应生成氢氧化钠,氢氧化钠与硫酸亚铁反应,所以反应方程式为:2Na+FeSO4+2H2O═Fe(OH)2↓+Na2SO4+H2↑,故答案为:2Na+FeSO4+2H2O═Fe(OH)2↓+Na2SO4+H2↑.
点评 本题考查了钠的性质,难度不大,会用化学语言描述钠与水反应的现象,会解释出现该现象的原因.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
4.下列属于物理变化的是( )
| A. | 铁棒锈蚀 | B. | 食物变质 | C. | 滴水成冰 | D. | 光合作用 |
1.下列各组离子在溶液中能大量共存,通入足量括号中气体后仍能大量共存的是( )
| A. | NH4+、Mg2+、SO42-、Cl- (NH3) | B. | Na+、Ba2+、Cl-、NO3- (SO2) | ||
| C. | Na+、Ca2+、ClO-、NO3- (HCl) | D. | K+、Fe3+、NO3-、SO42- (C12) |
8.将过量的CO2分别通入①CaCl2溶液;②Na2SiO3溶液;③NaAlO2溶液;④饱和Na2CO3溶液;⑤Ca(OH)2最终溶液中有白色沉淀析出的是( )
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ①②④ |
18.下表是不同温度下水的离子积数据:
试回答以下问题:
(1)25℃下,某 Na2SO4 溶液中 c(SO42-)=5×10-4mol?L-1,取该溶液 1mL 加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=1000:1.
(2)在 t 2℃下,将 a mol?L-1CH3COOH 溶液与 b mol?L-1NaOH 溶液等体积混合反应后,溶液恰好呈中性,则该温度下 CH3COOH 的电离常数 Ka=$\frac{b×1{0}^{-6}}{a-b}$(用 a、b 表示).
| 温度/℃ | 25 | t 1 | t 2 |
| 水的离子积 KW | 1×10-14 | 1×10-13 | 1×10-12 |
(1)25℃下,某 Na2SO4 溶液中 c(SO42-)=5×10-4mol?L-1,取该溶液 1mL 加水稀释至10mL,则稀释后溶液中 c(Na+):c(OH-)=1000:1.
(2)在 t 2℃下,将 a mol?L-1CH3COOH 溶液与 b mol?L-1NaOH 溶液等体积混合反应后,溶液恰好呈中性,则该温度下 CH3COOH 的电离常数 Ka=$\frac{b×1{0}^{-6}}{a-b}$(用 a、b 表示).
5.下列说法正确的是( )
| A. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| B. | 若 2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. |  如图可表示水分解过程中的能量变化 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ |
2.下列物质中既能与KMnO4溶液反应、又能与溴水反应的一组物质是( )
①苯 ②苯酚 ③甲苯 ④乙醇 ⑤己烯 ⑥己烷 ⑦亚硫酸 ⑧丙醛 ⑨聚乙烯 ⑩聚乙炔.
①苯 ②苯酚 ③甲苯 ④乙醇 ⑤己烯 ⑥己烷 ⑦亚硫酸 ⑧丙醛 ⑨聚乙烯 ⑩聚乙炔.
| A. | ②⑤⑧⑨⑩ | B. | ②④⑥⑦ | C. | ②⑤⑦⑧⑩ | D. | ①②③④⑤⑥⑦⑧ |
4.设阿伏加德罗常数的数值为nA,下列说法正确的是( )
| A. | 1molCl2溶于水反应,反应转移电子数为nA | |
| B. | 56g晶体硅中含有硅分子数为2nA | |
| C. | 1 mol Cu和足量稀硝酸反应产生nA个NO分子 | |
| D. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2nA |