题目内容
14.已知氯气在70℃的NaOH溶液中能发生两个反应,产物除水外还有氯化钠、次氯酸钠和氯酸钠(NaClO3),其中反应之一为3Cl2+6NaOH═5NaCl+NaClO3+3H2O,回答下列问题:(1)另一反应的化学方程式为Cl2+2NaOH═NaCl+NaClO+H2O
(2)经测定,产物中的氯化钠、次氯酸钠和氯酸钠的总物质的量为0.8mol,则参加反应的氯气的物质的量是多少?
分析 (1)氯气在70℃的NaOH溶液中能发生两个反应,产物除水外还有氯化钠、次氯酸钠和氯酸钠(NaClO3),其中反应之一为3Cl2+6NaOH═5NaCl+NaClO3+3H2O,则另一个反应是生成次氯酸钠的反应,方程式为:Cl2+2NaOH═NaCl+NaClO+H2O;
(2)根据氯守恒,2n(Cl2)=n(NaClO3)+n(NaClO)+n(NaCl),由此分析解答.
解答 解:(1)氯气在70℃的NaOH溶液中能发生两个反应,产物除水外还有氯化钠、次氯酸钠和氯酸钠(NaClO3),其中反应之一为3Cl2+6NaOH═5NaCl+NaClO3+3H2O,则另一个反应是生成次氯酸钠的反应,方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(2)根据氯守恒,2n(Cl2)=n(NaClO3)+n(NaClO)+n(NaCl)=0.8mol,所以n(Cl2)=$\frac{0.8mol}{2}$=0.4mol,答:参加反应的氯气的物质的量是0.4mol.
点评 本题考查氧化还原反应计算、根据方程式的计算等,难度较大,注意原子守恒和得失电子守恒法的利用.

练习册系列答案
相关题目
4.下列属于物理变化的是( )
| A. | 铁棒锈蚀 | B. | 食物变质 | C. | 滴水成冰 | D. | 光合作用 |
5.下列说法正确的是( )
| A. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| B. | 若 2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. |  如图可表示水分解过程中的能量变化 | |
| D. | 已知: Ⅰ:对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为(a+b+c)kJ |
2.下列物质中既能与KMnO4溶液反应、又能与溴水反应的一组物质是( )
①苯 ②苯酚 ③甲苯 ④乙醇 ⑤己烯 ⑥己烷 ⑦亚硫酸 ⑧丙醛 ⑨聚乙烯 ⑩聚乙炔.
①苯 ②苯酚 ③甲苯 ④乙醇 ⑤己烯 ⑥己烷 ⑦亚硫酸 ⑧丙醛 ⑨聚乙烯 ⑩聚乙炔.
| A. | ②⑤⑧⑨⑩ | B. | ②④⑥⑦ | C. | ②⑤⑦⑧⑩ | D. | ①②③④⑤⑥⑦⑧ |
9.如图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )
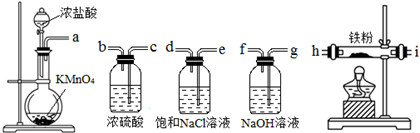

| A. | a-e-d-c-b-h-i-g | B. | a-d-e-c-b-h-i-g | C. | a-e-d-h-i-g-f-c | D. | a-b-c-d-e-f-g-h |
7.下列大小比较不正确的是( )
| A. | 熔沸点:SiO2>NaCl>S>CO2 | B. | 酸性:HNO2<HNO3;H3PO4<H2SO4 | ||
| C. | 还原性:H2S>HI>HBr>HCl | D. | 键长:C-H<N-H<O-H |
4.设阿伏加德罗常数的数值为nA,下列说法正确的是( )
| A. | 1molCl2溶于水反应,反应转移电子数为nA | |
| B. | 56g晶体硅中含有硅分子数为2nA | |
| C. | 1 mol Cu和足量稀硝酸反应产生nA个NO分子 | |
| D. | 标准状况下,1.12 L NO与1.12 L O2的混合物中含有的原子数为0.2nA |
5.下列过程有热量放出的是( )
| A. | 醋酸的电离 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |