题目内容
对可逆反应A(气)+2B(气)?2C(气)△H<0的平衡体系,下列说法错误的是( )
| A、使用催化剂,v正、v逆都改变,变化的倍数相同 |
| B、升高温度,v正、v逆都增大,v正增大的倍数小于v逆增大的倍数 |
| C、增大压强,v正、v逆反应的速率都增大,v正增大的倍数大于v逆增大的倍数 |
| D、降低温度,v正、v逆都减小,v正减小的倍数大于v逆减小的倍数 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、催化剂同等程度的改变正逆反应速率;
B、升高温度,化学反应速率加快,平衡向着吸热方向进行;
C、增大压强,正逆反应速率加快,平衡向着气体系数和减小的方向进行;
D、升高温度,化学反应速率减慢,平衡向着放热方向进行.
B、升高温度,化学反应速率加快,平衡向着吸热方向进行;
C、增大压强,正逆反应速率加快,平衡向着气体系数和减小的方向进行;
D、升高温度,化学反应速率减慢,平衡向着放热方向进行.
解答:
解:A、催化剂的催化特点:同等程度的改变正逆反应速率,故A正确;
B、升高温度,v正、v逆都增大,该反应的平衡向着吸热方向即逆方向进行,所以逆反应速率大于正反应速率,即v正增大的倍数小于v逆增大的倍数,故B正确;
C、增大压强,v正、v逆反应的速率都增大,平衡向着气体系数和减小的方即正方向即进行,正反应速率大于逆反应速率,即v正增大的倍数大于v逆增大的倍数,故C正确;
D、降低温度,v正、v逆都减小,平衡向着放热方向即正反应方向进行,正反应速率大于逆反应速率,即v正减小的倍数小于v逆减小的倍数,故D错误.
故选D.
B、升高温度,v正、v逆都增大,该反应的平衡向着吸热方向即逆方向进行,所以逆反应速率大于正反应速率,即v正增大的倍数小于v逆增大的倍数,故B正确;
C、增大压强,v正、v逆反应的速率都增大,平衡向着气体系数和减小的方即正方向即进行,正反应速率大于逆反应速率,即v正增大的倍数大于v逆增大的倍数,故C正确;
D、降低温度,v正、v逆都减小,平衡向着放热方向即正反应方向进行,正反应速率大于逆反应速率,即v正减小的倍数小于v逆减小的倍数,故D错误.
故选D.
点评:本题考查学生影响化学反应速率的因素以及平衡移动、移动方向之间的关系,注意知识的灵活应用是解题关键,化学平衡移动以及向哪里移动取决于正逆反应速率的大小关系,难度中等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
下列说法正确的是( )
| A、在多电子的原子里,能量高的电子通常在离核近的区域内活动 |
| B、任何元素的原子都是由核外电子和核内中子、质子组成的 |
| C、40 18Ar、40 19K、40 20Ca的质量数相同,所以它们是互为同位素 |
| D、核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 |
下列属于共价化合物的是( )
| A、NH4Cl |
| B、Na2O2 |
| C、H2O |
| D、NaNO3 |
根据热化学方程式:S(g)+O2(g)?SO2(g)△H=-Q kJ?mol-1,下列分析正确的是( )
| A、1 mol S(g)与1 mol O2(g)的总能量比1 mol SO2(g)的总能量低QkJ |
| B、1个S(g)与1个O2(g)完全反应要放出Q kJ的热量 |
| C、S(s)+O2(g)?SO2(g)△H<-Q kJ?mol-1 |
| D、1 mol S(g)与1 mol O2(g)反应生成1 mol SO2(g)放出QkJ的热量 |
下列氧化还原反应方程式,所标电子转移方向与数目错误的是( )
A、 |
B、 |
C、 |
D、 |
下列说法正确的是( )
| A、吸热反应一定需要加热才能完成 |
| B、反应条件中有加热的反应一定是吸热反应 |
| C、化学反应中的能量变化都为热量变化 |
| D、水煤气的制备反应是吸热反应 |
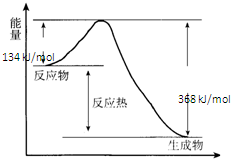 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.