题目内容
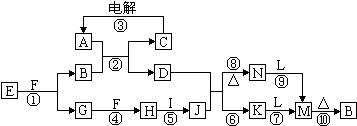
A、B、C均为短周期元素,它们在周期表中的位置如图所示.B、C两元素原子序数之和为A元素原子序数的4倍,则A、B、C依次是( )
| A | ||
| B | C |
| A、C、Al、P |
| B、N、Si、S |
| C、O、P、Cl |
| D、F、S、Ar |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:A、B、C均为短周期元素,所以它们应周期表的1、2、3周期,由于A所在族位于B和C的中间,所以A、B、C只能是第2和第3周期的元素,设A的原子序数为x,则根据B和C与A的相对位置关系可知,B的原子序数为x+7,C的原子序数为x+9,再根据B、C两元素原子序数之和为A元素原子序数的4倍,则可求得x=8,A、B、C依次为氧、磷、氯.
解答:
解:A、Al和P的原子序数之和为28,而C的原子序数是6,不满足4倍关系,故A不选;
B、硅和硫的原子序数之和为30,氮的原子序数是7,不满足4倍关系,故B不选;
C、磷、氯的原子序数之和为32,氧的原子序数是8,满足4倍关系,故C选;
D、硫、氩的原子序数之和为34,氟的原子序数是9,不满足4倍关系,故D不选;
故选C.
B、硅和硫的原子序数之和为30,氮的原子序数是7,不满足4倍关系,故B不选;
C、磷、氯的原子序数之和为32,氧的原子序数是8,满足4倍关系,故C选;
D、硫、氩的原子序数之和为34,氟的原子序数是9,不满足4倍关系,故D不选;
故选C.
点评:本题是考查学生对元素周期表和原子序数之间的关系的掌握情况,要求学生熟悉周期表的结构,熟记1到20号元素在周期表的位置.根据元素在周期表的位置特点,确定元素的种类,是对元素周期表中的“位”“构”“性”三者关系的简单综合应用.当然本题目也可以用排除法来解决.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列图象描述正确的是( )
A、 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 可判断可逆反应A2(g)+3B2(g)?2AB3(g)正反应是放热反应 |
B、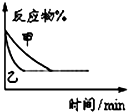 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |
C、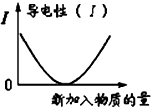 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
D、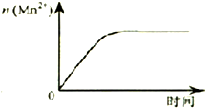 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 表示10mL 0.01 mol?L-1 KMnO4酸性溶液与过量的0.1mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
下列事实不能证明亚硝酸是弱电解质的是( )
| A、NaNO2在水溶液中完全电离 |
| B、HNO2能使石蕊试液变红 |
| C、等物质的量浓度的HNO2的导电能力比盐酸弱 |
| D、0.1mol/L的HNO2溶液的PH为2 |
下列离子方程式正确的是( )
| A、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| B、向Fe(OH)3中加入氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-=Fe3++NO↑+2H2O |
| D、向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O |
下列溶液中,阴离子浓度最大的是( )
| A、0.5mol?L-1 HNO3溶液50 mL |
| B、0.6mol?L-1 Al2(SO4)3溶液35mL |
| C、1.8mol?L-1 NaCl溶液70 mL |
| D、0.7mol?L-1 FeCl3溶液60mL |
已知0.1mol?L-1的NaHSO4溶液中,c(H+)=0.1mol?L-1,则NaHSO4在水溶液中的电离方程式是( )
| A、NaHSO4=Na++HSO4- |
| B、NaHSO4=Na++H++SO42- |
| C、NaHSO4=Na++H++S6++4O2- |
| D、NaHSO4=NaH2++SO42- |
国家卫生组织宣布,到2000年要消除碘缺乏病,为此食盐必须是国家统一标准的加碘盐,你认为加碘盐的指在食盐(NaCl)中添加适量的( )
| A、碘单质 | B、碘化钠 |
| C、碘酸钾 | D、次碘酸钾 |
 已知:C(金刚石,固)→C(石墨,固)+1.9kJ,则下列判断正确的是( )
已知:C(金刚石,固)→C(石墨,固)+1.9kJ,则下列判断正确的是( )| A、金刚石转变为石墨的能量的反应进程的关系可用右图表示 |
| B、等质量的石墨比金刚石能量高 |
| C、石墨比金刚石稳定 |
| D、金刚石转化为石墨没有化学键的断裂与生成 |