题目内容
下列事实不能证明亚硝酸是弱电解质的是( )
| A、NaNO2在水溶液中完全电离 |
| B、HNO2能使石蕊试液变红 |
| C、等物质的量浓度的HNO2的导电能力比盐酸弱 |
| D、0.1mol/L的HNO2溶液的PH为2 |
考点:弱电解质在水溶液中的电离平衡,强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:能说明亚硝酸(HNO2)为弱电解质,可证明亚硝酸不能完全电离、存在电离平衡或对应的强碱盐溶液呈碱性,以此解答该题.
解答:
解:A.NaNO2是易溶性的盐,属于强电解质在溶液中完全电离,不能说明亚硝酸是弱电解质,故A选;
B.HNO2能使石蕊试液变红,说明HNO2溶液显酸性,但是不能证明为弱酸,所以不能证明亚硝酸是弱电解质,故B选;
C.等物质的量浓度的HNO2的导电能力比盐酸弱,说明亚硝酸溶液中亚硝酸没有完全电离,则证明了亚硝酸是弱酸,故C不选;
D.0.1mol/L的亚硝酸水溶液的PH=2.,说明亚硝酸不能完全电离,为弱电解质,故D不选;
故选AB.
B.HNO2能使石蕊试液变红,说明HNO2溶液显酸性,但是不能证明为弱酸,所以不能证明亚硝酸是弱电解质,故B选;
C.等物质的量浓度的HNO2的导电能力比盐酸弱,说明亚硝酸溶液中亚硝酸没有完全电离,则证明了亚硝酸是弱酸,故C不选;
D.0.1mol/L的亚硝酸水溶液的PH=2.,说明亚硝酸不能完全电离,为弱电解质,故D不选;
故选AB.
点评:本题考查弱电解质的实验设计的评价,侧重于考查学生实验评价能力和分析能力,注意把握弱电解质的电离特点和实验设计的角度,题目难度不大.

练习册系列答案
相关题目
在无色透明的酸性溶液中,能大量共存的离子组是( )
| A、Al3+、Na+、Cl-、SO42- |
| B、Cu2+、Ca2+、CO32-、Cl- |
| C、NH4+、Ba2+、NO3-、HCO3- |
| D、K+、Fe3+、Cl-、NO3- |
下列溶液中Cl-的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl-物质的量浓度相等的是( )
| A、150mL 2mol/L KCl溶液 |
| B、75mL 1.5mol/L MgCl2溶液 |
| C、100mL 1mol/L NaCl溶液 |
| D、25mL 2mol/L AlCl3溶液 |
根据下表中烃的分子式排列规律,空格中烃的同分异构体中一氯代物种数不可能是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A、1种 | B、2种 | C、3种 | D、4种 |
化合物CH3CHO 属于( )
| A、.醇 | B、.酮 | C、.醛 | D、烃 |
A、B、C均为短周期元素,它们在周期表中的位置如图所示.B、C两元素原子序数之和为A元素原子序数的4倍,则A、B、C依次是( )
| A | ||
| B | C |
| A、C、Al、P |
| B、N、Si、S |
| C、O、P、Cl |
| D、F、S、Ar |
下列有关平衡常数(K、Ka、Kw、Ksp)的说法中错误的是( )
| A、若各平衡常数(K、Ka、Kw、Ksp)的值发生变化,则平衡一定发生移动 |
| B、若温度升高,则各平衡常数一定增大 |
| C、平衡常数的大小能说明反应(或电离、溶解)进行的程度 |
| D、某一可逆反应的平衡常数越大,表明反应(或电离、溶解)进行的程度越大 |
下列反应的有机产物,肯定是一种的是( )
A、异戊二烯(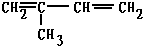 )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 |
B、2-氯丁烷(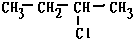 )与NaOH溶液共热发生反应 )与NaOH溶液共热发生反应 |
| C、甲苯在一定条件下发生硝化生成一硝基甲苯的反应 |
| D、等物质的量的甲烷和氯气的混和气体长时间光照后的产物 |