题目内容
9.某化学学习小组设计如图实验装置(夹持装置略去)制备氯气并探究氯气的相关性质.D装置为分液漏斗形状,低进高出.
(1)若A装置中固体药品为MnO2,写出其离子反应方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;若A装置中固体药品为KC1O3,则反应中每生成1mol Cl2时转移电子数目为1.67NA或$\frac{5}{3}$NA.
(2)装置B的作用是除去HCl气体和贮存少量C12,若C处发生了堵塞,则B中的现象长颈漏斗内的液面上升,瓶内液面下降.
(3)装置C的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是无水CaC12和干燥的红布条.
分析 在加热条件下,浓盐酸和二氧化锰在A中反应生成氯气,浓盐酸具有挥发性,导致生成的氯气中含有HCl,用饱和食盐水除去氯气中HCl,氯气没有漂白性但次氯酸没有漂白性,氯气和溴化钠反应生成溴,溴能和KI反应生成碘单质,氯气有毒不能排空,应该用NaOH溶液处理尾气;
(1)加热条件下,浓盐酸和二氧化锰反应生成氯气;和盐酸反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,根据氯气和转移电子之间关系式计算;
(2)饱和食盐水能抑制氯气溶解且能溶解氯化氢,该装置还能贮存少量氯气;
C装置发生堵塞会导致B中压强增大;
(3)要验证氯气没有漂白性,应该用干燥剂干燥氯气然后用干燥的红色布条检验.
解答 解:在加热条件下,浓盐酸和二氧化锰在A中反应生成氯气,浓盐酸具有挥发性,导致生成的氯气中含有HCl,用饱和食盐水除去氯气中HCl,氯气没有漂白性但次氯酸没有漂白性,氯气和溴化钠反应生成溴,溴能和KI反应生成碘单质,氯气有毒不能排空,应该用NaOH溶液处理尾气;
(1)加热条件下,浓盐酸和二氧化锰反应生成氯气,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;和盐酸反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,反应生成3molCl2,转移电子5mol,则反应中每生成1mol Cl2时转移电子个数为1.67NA或$\frac{5}{3}$NA,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;1.67NA或$\frac{5}{3}$NA;
(2)饱和食盐水能抑制氯气溶解且能溶解氯化氢,该装置还能贮存少量氯气,所以B装置作用是除去HCl气体、贮存少量C12;
C装置发生堵塞会导致B中压强增大,长颈漏斗内的液面上升,瓶内液面下降,
故答案为:除去HCl气体;贮存少量C12;长颈漏斗内的液面上升,瓶内液面下降;
(3)要验证氯气没有漂白性,应该用干燥剂干燥氯气然后用干燥的红色布条检验,则II、III处加入的物质为无水CaC12和干燥的红布条,
故答案为:无水CaC12;干燥的红布条.
点评 本题考查性质实验方案设计,为高频考点,涉及气体制备、除杂、干燥、尾气处理及氧化还原反应,明确实验原理、实验操作是解本题关键,题目难度中等.

| A. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| B. | Al2O3熔点高,可用作耐高温材料 | |
| C. | 铁比铜金属性强,可用FeCl3腐蚀Cu刻制印刷电路板 | |
| D. | NaHCO3溶于水呈碱性,可作抗酸药,服用时喝些醋能提高药效 |
| A. | 金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;2 Na+2 H2O═2 NaOH+H2↑ | |
| B. | 氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | |
| C. | FeSO4溶液中加入NaOH溶液时,生成的白色絮状沉淀迅速变为灰绿色,最后变成红褐色; 2Fe(OH)2+O2+H2O═2 Fe(OH)3 | |
| D. | 向Na2SiO3溶液中逐滴加入稀盐酸,边加边振荡,有透明的硅酸凝胶产生;Na2SiO3+2HCl═H2SiO3(胶体)+2NaCl |
| A. | 常温下,向醋酸溶液中加入少量的水,溶液中c(H+)将增大 | |
| B. | 常温下,2NO(g)+2CO(g)?N2(g)+2CO2(g)能自发进行,则该反应的△H<0 | |
| C. | 硫酸铜饱和溶液降低温度时有晶体析出,可用熵判据来解释 | |
| D. | 用CH3COOH溶液做导电实验,灯泡很暗,一定能证明CH3COOH是弱电解质 |

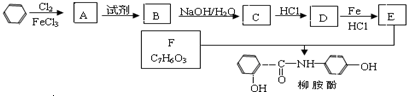
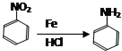
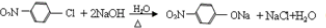 .
.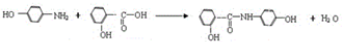 .
. .
.
 .
.