题目内容
6.四氯化锡(SnCl4)常用于印染和电镀工业.【实验Ⅰ】:金属Sn的制备
(1)以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为SnO2+2C$\frac{\underline{\;高温\;}}{\;}$Sn+2CO.
(2)粗锡经电解精炼可得纯锡,精炼时粗锡连接电源的正(填正、负极).
【实验Ⅱ】:SnCl4的制备
某兴趣小组用图1装置,用熔融的金属锡11.9克与干燥纯净的氯气制取无水SnCl4,此反应过程放出大量的热.
已知:①Sn的熔点:231℃
②SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解
(3)装置A中反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑.
(4)装置B中应加入试剂为饱和食盐水.
(5)反应开始生成SnCl4后,可以先熄灭D处的酒精灯,理由是依靠反应放出的热量维持Sn的熔化.
(6)有同学认为该实验装置设计有两处明显缺陷,其中一处应在F装置后再连接X、Z(填符号)装置(如图2),选择的理由是氯气有毒,会污染空气,可以用碱石灰或氢氧化钠溶液吸收.
(7)实验装置改进后若在F中收集到20.9克SnCl4,则锡的利用率约为80%.

分析 【实验Ⅰ】:(1)根据反应物和生成物,利用质量守恒定律可写出化学方程式;
(2)电解精炼可得纯锡,精炼时的阴极发生还原反应生成得到纯Sn,阳极为粗锡;
【实验Ⅱ】:(3)A为实验室用浓盐酸与二氧化锰加热制备氯气的反应,据此写离子方程式;
(4)根据实验装置图可知,制得的氯气中氯化氢和水,需要除去,先用饱和食盐水除氯化氢,再用浓硫酸除水;
(5)根据题意,该反应放热,停止加热B装置,可依靠反应放出的热量维持Sn的熔化;
(6)本实验中装置最后排出的气体为未反应的氯气,氯气有毒,会污染空气,要吸收;
(7)根据SnCl4可计算出参加反应的锡的质量,根据锡的利用率=$\frac{参加反应的锡的质量}{开始取用的锡的质量}$进而计算.
解答 解:【实验Ⅰ】:(1)根据反应物和生成物,利用质量守恒定律可写出化学方程式为SnO2+2C$\frac{\underline{\;高温\;}}{\;}$Sn+2CO,
故答案为:SnO2+2C$\frac{\underline{\;高温\;}}{\;}$Sn+2CO;
(2)电解精炼可得纯锡,精炼时的阴极发生还原反应生成得到纯Sn,阳极为粗锡,所以粗锡与电源正极相连,
故答案为:正;
【实验Ⅱ】:(3)A为实验室用浓盐酸与二氧化锰加热制备氯气的反应,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;
(4)根据实验装置图可知,制得的氯气中氯化氢和水,需要除去,先用饱和食盐水除氯化氢,再用浓硫酸除水,所以B装置应加入饱和食盐水,
故答案为:饱和食盐水;
(5)该反应放热,熄灭D处的酒精灯,可依靠反应放出的热量维持Sn的熔化,
故答案为:依靠反应放出的热量维持Sn的熔化;
(6)本实验中装置最后排出的气体为未反应的氯气,氯气有毒,会污染空气,氯气可以用碱石灰或氢氧化钠溶液吸收,故选X、Z,
故答案为:X、Z;氯气有毒,会污染空气,可以用碱石灰或氢氧化钠溶液吸收;
(7)根据20.9克SnCl4可计算出参加反应的锡的质量为$\frac{119}{261}$×20.9g=9.53g,所以锡的利用率=$\frac{参加反应的锡的质量}{开始取用的锡的质量}$×100%=$\frac{9.53}{11.9}$×100%=80%,
故答案为:80%.
点评 本题考查较为综合,涉及到物质的制备、电解、除杂等问题实验方案的设计和评价,中等难度.

| A. | 22 | B. | 22mol | C. | 44g | D. | 44g•mol-1 |
| A. | 23g钠的原子最外层电子数为2NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4L乙烷的分子数为NA | |
| D. | 1mol甲基所含质子数为10NA |
 .
.
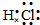 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)
,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)

 ;
;


 .
.