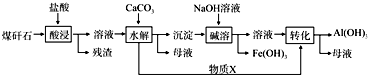
题目内容
15.现有四种单质组成的合金A,已分析出其中含有硅,为分析出其他成分,用此合金进行一系列实验,其过程及发生反应的现象如下图所示.(部分产物略去)(提示:Si+2NaOH═Na2SiO3+2H2↑)(1)无色气体B是H2;
(2)写出A中除硅以外的物质与烧碱溶液反应的两种方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑或Si+2NaOH+H2O=Na2SiO3+2H2↑;
(3)写出固体F与浓硝酸反应的化学方程式,并用单线桥标出电子转移的方向和数目
 ;
;(4)测得浅绿色溶液的pH为5,请写出向浅绿色溶液中加入少量NaClO溶液后的总离子方程式2Fe2++2H++ClO-=2Fe3++Cl-+H2O.
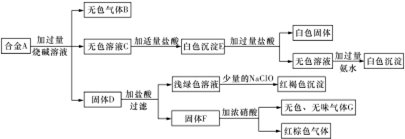
分析 合金与氢氧化钠溶液反应,生成无色可燃气体B,B为H2,合金可能含有Al、Si;
合金与氢氧化钠溶液反应,得到的无色溶液C,C中加入适量盐酸生成白色沉淀E,沉淀E加入过量盐酸,有白色固体,该白色固体为H2SiO3,向加入过量盐酸得到无色溶液中加过量氨水,生成白色沉淀,该白色沉淀为Al(OH)3,故合金含有Si、Al,白色沉淀E为H2SiO3、Al(OH)3;
固体D加入盐酸生成氢气与浅绿色溶液,浅绿色溶液中加入次氯酸钠,生成红褐色沉淀,为Fe(OH)3,故D中含有铁,即合金中含有铁;
固体D加入盐酸后过滤得到不溶物F,F加浓硝酸生成无色、无刺激性的气体G,以及红棕色气体NO2,F为C,符合转化关系与题意,G为CO2,故合金中含有碳单质,据此答题;
解答 解:合金与氢氧化钠溶液反应,生成无色可燃气体B,B为H2,合金可能含有Al、Si;
合金与氢氧化钠溶液反应,得到的无色溶液C,C中加入盐酸生成白色沉淀E,沉淀E加入过量盐酸,有白色固体,该白色固体为H2SiO3,向加入过量盐酸得到无色溶液中加过量氨水,生成白色沉淀,该白色沉淀为Al(OH)3,故合金含有Si、Al,白色沉淀E为H2SiO3、Al(OH)3;
固体D加入盐酸生成氢气与浅绿色溶液,浅绿色溶液中加入漂白粉,生成红褐色沉淀,为Fe(OH)3,故D中含有铁,即合金中含有铁,浅绿色溶液为FeSO4溶液;
固体D加入盐酸后过滤得到不溶物F,F燃烧生成无色、无刺激性的气体G,与浓硝酸反应生成红棕色气体NO2,F为碳符合转化关系与题意,G为CO2,故合金中含有碳单质,
(1)根据上面分析可知,无色气体B是H2,
故答案为:H2;
(2)根据上面分析可知,A中除硅以外还有铝能与烧碱溶液反应的两种方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑或Si+2OH-+H2O=SiO32-+2H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑或Si+2NaOH+H2O=Na2SiO3+2H2↑;
(3)固体C与浓硝酸反应生成二氧化碳和二氧化氮,反应的化学方程式并用单线桥标出电子转移的方向和数目为 ,
,
故答案为: ;
;
(4)浅绿色溶液为FeSO4溶液,测得浅绿色溶液的pH为5,向浅绿色溶液中加入少量NaClO溶液后的总离子方程式为2Fe2++2H++ClO-=2Fe3++Cl-+H2O,
故答案为:2Fe2++2H++ClO-=2Fe3++Cl-+H2O.
点评 本题以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语、离子方程式书写等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,电解池原理的分析应用.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A | |||||||
| B | C | D |
(1)元素C在元素周期表中的位置是第三周期ⅢA族;
(2)A和D的氢化物中,沸点较高的是HF(写化学式),原因是HF与HCl均形成分子晶体,HF的氢化物分子间可以形成氢键,而D的氢化物HCl不能形成氢键;
(3)写出B最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
| A. | Na+、Fe2+、Cl-、NO3- | B. | Na+、Ca2+、HCO3-、NO3- | ||
| C. | Al3+、Mg2+、SO42-、Na+ | D. | Na+、NH4+、CO32-、SO42- |
| A. | 氧元素的主要化合价为-2、+6 | B. | N2H4是共价化合物 | ||
| C. | 氮的最高价态氧化物为NO2 | D. | 原子半径:H<N<O |
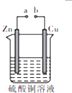
| A. | a和b不连接时,锌片上会有紫红色固体析出 | |
| B. | a和b用导线连接时,铜片上的电极反应是Cu2++2e-→Cu | |
| C. | a和b用导线连接时,溶液的颜色加深 | |
| D. | 无论a和b是否连接,锌片均会溶解 |
| A. | 人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 | |
| B. | 道尔顿、汤姆生、卢瑟福和门捷列夫等对原子结构模型的建立均作出了卓越的贡献 | |
| C. | 化学反应能制造出新的物质,也能制造出新的元素,并伴有能量变化 | |
| D. | 感染MERS致死率较高,为防止感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |

| A. | 乙醇和钠反应,键①断裂 | B. | 铜催化下和O2反应,键①③断裂 | ||
| C. | 乙醇与乙酸反应,键①断裂 | D. | 铜催化和O2反应,键①②断裂 |