题目内容
20.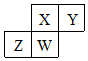 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 元素X、Y、Z、W的最高化合价分别与其主族序数相等 | |
| C. | 最简单气态氢化物的热稳定性:H2Y>XH3>WH3>ZH4 | |
| D. | 最高价氧化物对应水化物的酸性:HXO3>H3WO4>H2ZO3 |
分析 由短周期元素X、Y、Z、W在元素周期表中的相对位置图,W为第三周期元素,其中W原子的质子数是其最外层电子数的三倍,则W为P,质子数为15,最外层电子数为5,结合位置可知,X为N,Y为O,Z为Si,然后结合元素周期律及元素化合物知识来解答.
解答 解:由短周期元素X、Y、Z、W在元素周期表中的相对位置图,W为第三周期元素,其中W原子的质子数是其最外层电子数的三倍,则W为P,质子数为15,最外层电子数为5,结合位置可知,X为N,Y为O,Z为Si,
A.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:Z>W>X>Y,故A正确;
B.Y为O,无正价,则X、Z、W的最高化合价分别与其主族序数相等,故B错误;
C.非金属性越强,氢化物越稳定,则最简单气态氢化物的热稳定性:H2Y>XH3>WH3>ZH4,故C正确;
D.非金属性越强,对应最高价氧化物对应水化物酸性越强,则最高价氧化物对应水化物的酸性:HXO3>H3WO4>H2ZO3,故D正确;
故选B.
点评 本题考查位置、结构及性质的综合应用,为高频考点,把握元素的位置、元素的性质为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及周期律的应用,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
10.如果n为第ⅡA族中某元素原子序数,则原子序数为(n+1)的元素位于( )
①ⅢA ②ⅣA ③ⅢB ④ⅠA.
①ⅢA ②ⅣA ③ⅢB ④ⅠA.
| A. | ①③ | B. | ①② | C. | ②③ | D. | ①③④ |
15.下列有关有机物的说法正确的是( )
| A. | 石油的分馏和煤的气化、液化都是物理变化 | |
| B. | 以淀粉为原料可制取乙酸乙酯 | |
| C. | 分子式为C4H9Cl的同分异构体有2种 | |
| D. | 聚乙烯、丙炔、裂化汽油都可以使溴水褪色 |
5.下列关于元素周期表的叙述中正确的是( )
| A. | 元素周期表共有18个族 | |
| B. | 含有元素种类最多的族是第ⅠA 族 | |
| C. | 含有元素种类最多的周期是第六周期 | |
| D. | 第五周期有14种金属元素 |
12.A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
(1)元素Y是C下一周期同主族元素,比较B、Y元素第一电离能的大小I1(B)>I1(Y).
(填“>”或“=”或“<”)
(2)E元素原子的核外电子排布式为1s22s22p63s23p63d 64s2.
(3)B元素最高价含氧酸一定比D元素最高价含氧酸的酸性强(填“强”或“弱”).
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键.
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: .写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体 |
| E | E的单质是日常生活中用量最大的金属材料 |
(填“>”或“=”或“<”)
(2)E元素原子的核外电子排布式为1s22s22p63s23p63d 64s2.
(3)B元素最高价含氧酸一定比D元素最高价含氧酸的酸性强(填“强”或“弱”).
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键.
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:
 .写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
.写出该阳离子与硫的氢化物的水溶液反应出现黄色浑浊的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
9.容量瓶上不需要标明的是( )
| A. | 温度 | B. | 物质的量浓度 | C. | 规格 | D. | 刻度线 |
10.由1-氯丙烷合成少量的2-丙醇,需要经过下列哪几步反应( )
| A. | 加成→消去→取代 | B. | 消去→加成→水解 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |

 和CH3CH2CH2CH2CH3.
和CH3CH2CH2CH2CH3.