题目内容
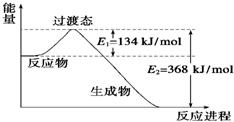 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:(2))依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=C02(g)△H1=-393.5kJ?mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ?mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ?mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:
△H=
(3)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g水和2.24L CO2(标准状况),并放出68.35kJ热量,则该反应的热化学方程式为:
考点:热化学方程式,有关反应热的计算
专题:化学反应中的能量变化
分析:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
(2)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
(3)依据题干信息结合元素守恒计算有机物,依据热化学方程式书写方法标注物质聚集状态和反应焓变写出;
(2)可以先根据反应物和生成物书写化学方程式,根据盖斯定律计算反应的焓变,最后根据热化学方程式的书写方法来书写热化学方程式;
(3)依据题干信息结合元素守恒计算有机物,依据热化学方程式书写方法标注物质聚集状态和反应焓变写出;
解答:
解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;
(3)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ?mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ?mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×
-③×
得到,
所以反应焓变△H=2×(-393.5kJ?mol-1)+(-571.6kJ?mol-1)×
-(-2599kJ?mol-1)×
=+226.7kJ?mol-1,
故答案为:226.7kJ?mol-1;
(3)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g水物质的量=
=0.15mol,2.24L CO2(标准状况)物质的量=
=0.1mol,n(C)=0.1mol,n(H)=0.3mol,n(O)=
=0.05mol,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6;1,化学式为C2H6O,物质的量为0.05mol,并放出68.35kJ热量,1mol有机物燃烧放热1367KJ,热化学方程式为:C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367kJ/mol;
故答案为:C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367kJ/mol.
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;
(3)已知:①C (s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1;
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ?mol-1;
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O (l)△H2=-2599kJ?mol-1;
2C (s,石墨)+H2(g)=C2H2(g)的反应可以根据①×2+②×
| 1 |
| 2 |
| 1 |
| 2 |
所以反应焓变△H=2×(-393.5kJ?mol-1)+(-571.6kJ?mol-1)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:226.7kJ?mol-1;
(3)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g水物质的量=
| 2.7g |
| 18g/mol |
| 2.24L |
| 22.4L/mol |
| 2.3g-0.1mol×12g/mol-0.3mol×1g/mol |
| 16g/mol |
故答案为:C2H6O(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1367kJ/mol.
点评:本题考查了热化学方程式书写和盖斯定律计算应用,注意利用元素守恒计算有机物的化学式方法,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列各组离子在给定条件下的溶液中,一定能够大量共存的是( )
| A、在碱性溶液中 Na+、K+、Cl-、S2- |
| B、在pH=13的溶液中 Al3+、Na+、SO42-、Cl- |
| C、在水电离出的氢离子浓度为1×10-13的溶液中 Na+、NH4+、AlO2-、CO32- |
| D、在无色透明的溶液中 Na+、K+、MnO4-、NO3- |
 夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.请回答下列问题:
夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣.璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应.鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色.请回答下列问题: ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: