题目内容
下列各组离子在给定条件下的溶液中,一定能够大量共存的是( )
| A、在碱性溶液中 Na+、K+、Cl-、S2- |
| B、在pH=13的溶液中 Al3+、Na+、SO42-、Cl- |
| C、在水电离出的氢离子浓度为1×10-13的溶液中 Na+、NH4+、AlO2-、CO32- |
| D、在无色透明的溶液中 Na+、K+、MnO4-、NO3- |
考点:离子共存问题
专题:离子反应专题
分析:A.该组离子之间不反应;
B.pH=13的溶液,显碱性;
C.水电离出的氢离子浓度为1×10-13的溶液,为酸或碱溶液;
D.MnO4-为紫色.
B.pH=13的溶液,显碱性;
C.水电离出的氢离子浓度为1×10-13的溶液,为酸或碱溶液;
D.MnO4-为紫色.
解答:
解:A.该组离子之间不反应,可大量共存,故A正确;
B.pH=13的溶液,显碱性,不能大量存在Al3+,故B错误;
C.水电离出的氢离子浓度为1×10-13的溶液,为酸或碱溶液,酸溶液中不能大量存在AlO2-、CO32-,碱溶液中不能大量存在NH4+,故C错误;
D.MnO4-为紫色,与无色不符,故D错误;
故选A.
B.pH=13的溶液,显碱性,不能大量存在Al3+,故B错误;
C.水电离出的氢离子浓度为1×10-13的溶液,为酸或碱溶液,酸溶液中不能大量存在AlO2-、CO32-,碱溶液中不能大量存在NH4+,故C错误;
D.MnO4-为紫色,与无色不符,故D错误;
故选A.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意常见离子的颜色,题目难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
下列物质中,能够导电的化合物是( )
| A、熔融氯化钠 |
| B、盐酸 |
| C、NaOH |
| D、CO2 |
俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果成功制成4个第115号元素的原子,其与N元素同主族.这4个原子在生成数微秒后衰变成第113号元素.前者的一种核素为
X.下列有关叙述正确的是( )
288 115 |
| A、115号元素衰变成113号元素是化学变化 | ||
B、核素
| ||
| C、113号元素其质量数为113 | ||
| D、因115号元素与N元素同主族,所以定为非金属元素 |
分类法在化学学科发展中起到了非常重要作用.下列分类标准合理的是( )
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
②根据酸分子中含氢原子的个数将酸分为一元酸、二元酸、三元酸
③根据分散质粒子直径的大小将分散系分为溶液、胶体、浊液
④根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素.
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
②根据酸分子中含氢原子的个数将酸分为一元酸、二元酸、三元酸
③根据分散质粒子直径的大小将分散系分为溶液、胶体、浊液
④根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素.
| A、③ | B、①③ | C、②③ | D、①②③④ |
某无色透明溶液,在酸性环境下能大量共存的离子组是( )
| A、Na+K+AlO2-Cl- |
| B、Na+SO42-HCO3-C1- |
| C、K+MnO4- NO3-Fe2+ |
| D、Mg2+Cl-NH4+SO42- |
下列叙述正确的是( )
| A、1摩尔氧 |
| B、有大量有毒易燃气体在室内扩散,不能立即打开排风扇开关 |
| C、1L水中溶解224 L HCl气体(标准状况下测得)后形成溶液物质的量浓度为10 mol?L-1 |
| D、将7.4克氢氧化钙放入烧杯中,加水搅拌冷却后全部转移到100 mL容量瓶并加水至刻度线,浓度为1 mol?L-1 |
R元素的一种粒子的结构示意图为 ,则下列说法不正确的是( )
,则下列说法不正确的是( )
 ,则下列说法不正确的是( )
,则下列说法不正确的是( )| A、该粒子容易得电子 |
| B、该粒子的核外有3个电子层 |
| C、R元素为金属元素 |
| D、R元素的原子有11个电子 |
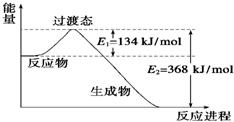 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )