题目内容
在浓硝酸中放入铜片
(1)反应开始时的化学方程式: ,实验现象为 .
(2)若铜片有剩余,则反应将要结束时的化学反应方程式 .
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是 .
(4)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完后,共产生气体5.6L(标准状况),则所消耗的硝酸的物质的量是 ,所得气体的平均相对分子质量为 .
(1)反应开始时的化学方程式:
(2)若铜片有剩余,则反应将要结束时的化学反应方程式
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是
(4)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完后,共产生气体5.6L(标准状况),则所消耗的硝酸的物质的量是
考点:硝酸的化学性质,化学方程式的有关计算
专题:计算题,元素及其化合物
分析:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,二氧化氮是红棕色气体,铁盐溶液呈黄色;
(2)铜有剩余,铜和稀硝酸反应生成硝酸铜和NO;
(3)酸性条件下,硝酸根离子具有强氧化性,又继续和铜反应;
(4)铜和硝酸反应生成硝酸铜与氮的氧化物(NO或NO2或NO、NO2的混合物),反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量;
依据氧化剂与得到的电子数与还原剂失去的电子数相等计算二氧化氮和一氧化氮的物质的量进而求其相对分子质量.
(2)铜有剩余,铜和稀硝酸反应生成硝酸铜和NO;
(3)酸性条件下,硝酸根离子具有强氧化性,又继续和铜反应;
(4)铜和硝酸反应生成硝酸铜与氮的氧化物(NO或NO2或NO、NO2的混合物),反应中硝酸其氧化剂、酸性作用,起氧化剂作用的硝酸生成氮的氧化物,起酸性作用的硝酸生成Cu(NO3)2,根据氮原子守恒:2n[Cu(NO3)2]+n(NO、NO2),据此计算消耗硝酸的物质的量;
依据氧化剂与得到的电子数与还原剂失去的电子数相等计算二氧化氮和一氧化氮的物质的量进而求其相对分子质量.
解答:
解:(1)铜和浓硝酸反应生成硝酸铜、二氧化氮和水,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮是红棕色气体,铜盐溶液呈蓝色,所以看到的现象是:溶液逐渐变蓝色,有红棕色气体逸出,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;溶液逐渐变蓝色,有红棕色气体逸出;
(2)铜有剩余,随着反应的进行,硝酸浓度逐渐减小,当变为稀硝酸时,铜和稀硝酸反应生成硝酸铜和NO,反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应,发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应.
(4)12.8gCu的物质的量=
=0.2mol,气体的物质的量=
=0.25mol,
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol;
Cu跟一定量的浓硝酸反应首先生成二氧化氮,随着反应的进行,硝酸的浓度变稀,反应生成一氧化氮,依据氧化还原反应的规律可知铜失去的电子总数等于硝酸得到的电子总数,设生成的二氧化氮的物质的量xmol,生成的一氧化氮的物质的量为ymol,
依据氮原子个数守恒的:x+y=
=0.25mol;
依据得失电子相等得:
×2=x+3y,
解得:x=0.175mol,y=0.075mol,
气体的平均摩尔质量=
=41.2g/mol;
所以其平均相对分子质量为41.2;
故答案为:0.65mol;41.2.
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;溶液逐渐变蓝色,有红棕色气体逸出;
(2)铜有剩余,随着反应的进行,硝酸浓度逐渐减小,当变为稀硝酸时,铜和稀硝酸反应生成硝酸铜和NO,反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(3)加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应,发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:加入稀硫酸后,氢离子原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应.
(4)12.8gCu的物质的量=
| 12.8g |
| 64g/mol |
| 5.6L |
| 22.4L/mol |
根据氮原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO、NO2)=2×0.2mol+0.25mol=0.65mol;
Cu跟一定量的浓硝酸反应首先生成二氧化氮,随着反应的进行,硝酸的浓度变稀,反应生成一氧化氮,依据氧化还原反应的规律可知铜失去的电子总数等于硝酸得到的电子总数,设生成的二氧化氮的物质的量xmol,生成的一氧化氮的物质的量为ymol,
依据氮原子个数守恒的:x+y=
| 5.6L |
| 22.4L/mol |
依据得失电子相等得:
| 12.8g |
| 64g/mol |
解得:x=0.175mol,y=0.075mol,
气体的平均摩尔质量=
| 0.175mol×46g/mol+0.075mol×30g/mol |
| 025mol |
所以其平均相对分子质量为41.2;
故答案为:0.65mol;41.2.
点评:本题考查了硝酸的性质及氧化还原反应计算,难度中等,注意利用氮原子个数守恒和得失电子数守恒思想计算.

练习册系列答案
相关题目
下列物质中,能够导电的化合物是( )
| A、熔融氯化钠 |
| B、盐酸 |
| C、NaOH |
| D、CO2 |
俄罗斯科学家在利用回旋加速器进行的实验中,用含20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果成功制成4个第115号元素的原子,其与N元素同主族.这4个原子在生成数微秒后衰变成第113号元素.前者的一种核素为
X.下列有关叙述正确的是( )
288 115 |
| A、115号元素衰变成113号元素是化学变化 | ||
B、核素
| ||
| C、113号元素其质量数为113 | ||
| D、因115号元素与N元素同主族,所以定为非金属元素 |
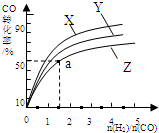 研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.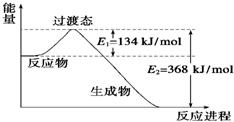 (1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:

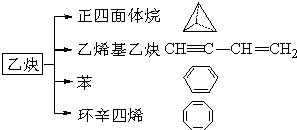 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题:
 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )