题目内容
17.某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2).为了制取Cl2和探究氯及其化合物的相关性质,进行如下实验.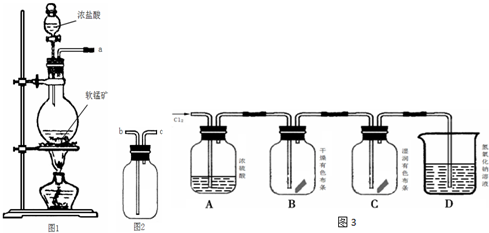
【查阅资料】MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
【制取气体】
(1)取适量矿样置于烧瓶中,加入足量浓盐酸并加热,充分反应后,烧瓶中残留的固体是二氧化硅.
(2)收集氯气应将图1导管的a接口与图2的导管的b接口连接(填“b”或“c”)
(3)若生成标准状况下11.2LCl2,则参加反应的MnO2的质量为43.5g.
【实验探究】
(4)把红热的铁丝伸入盛有氯气的集气瓶中,铁丝燃烧产生棕褐色的烟.反应的化学方程式是2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(5)按图3进行实验,观察到B中的有色布条不褪色,C中的有色布条褪色.由此得出的结论是氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性.
(6)写出D中反应的化学方程式:??Cl2+2NaOH=NaCl+NaClO+H2O??.
【知识拓展】
(7)某同学查阅资料得知:高锰酸钾与浓盐酸在常温正好生反应也可以生成氯气(反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O),该反应的氧化剂是高锰酸钾.
分析 (1)二氧化锰能够与浓盐酸反应生成氯化锰溶液、氯气和水,二氧化硅与盐酸不反应的性质解答;
(2)依据氯气密度大于空气密度,应采用向上排空气法收集解答;
(3)依据方程式:MnO2+4HCl(浓) $\frac{\underline{\;加热\;}}{\;}$ MnCl2+Cl2↑+2H2O计算;
(4)铁丝与氯气在点燃条件下反应生成氯化铁;
(5)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性;
(6)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(7)氧化剂在反应中所含元素化合价降低,据此判断.
解答 解:(1)软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2),二氧化锰能够与浓盐酸反应生成氯化锰溶液、氯气和水,二氧化硅与盐酸不反应,所以剩余固体为二氧化硅;
故答案为:二氧化硅;
(2)氯气密度大于空气密度,应采用向上排空气法收集,所以收集氯气应将图1导管的a接口与图2的导管的b接口连接;
故答案为:b;
(3)设参加反应的二氧化锰质量为m则:
MnO2+4HCl(浓) $\frac{\underline{\;加热\;}}{\;}$ MnCl2+Cl2↑+2H2O
87g 22.4L
m 11.2L
解得m=43.5g;
故答案为:43.5;
(4)铁丝与氯气在点燃条件下反应生成氯化铁,化学方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(5)观察到B中的有色布条不褪色,C中的有色布条褪色.由此得出的结论是:氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性;
故答案为:氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性;
(6)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(7)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,+7价锰元素化合价降为+2价,所以高锰酸钾为氧化剂;
故答案为:高锰酸钾.
点评 本题考查了氯气的制备和性质的检验,熟悉氯气制备原理和性质是解题关键,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 青蒿素的摩尔质量是282 g/mol | |
| B. | 从植物黄花蒿茎叶中提取青蒿素可能会经过一系列复杂的变化 | |
| C. | 从题干信息推测,青蒿素应属于原子晶体 | |
| D. | 服用青蒿素治疗疟疾时,应用水在较低温度下溶解,以增强治疗功效 |
| A. | 工业上利用电解饱和食盐水的产物制盐酸 | |
| B. | 工业上制备漂白粉 | |
| C. | 实验室制取氯气 | |
| D. | 炼铁工业上用石灰石除杂造渣 |
| A. | 7.1gCl2与足量的氢氧化钠溶液反应,转移的电子数一定为0.2NA | |
| B. | 标准状况下,22.4L SO3中含有氧原子数为3 NA | |
| C. | 标准状况下,18g H2O中含有氧原子数为NA | |
| D. | 5.4g 铝单质与足量NaOH溶液反应,转移电子数为0.6NA |