题目内容
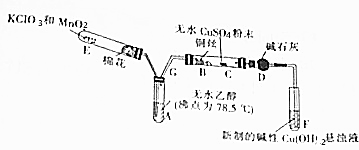
20.下列实验过程中,始终无明显现象的是( )| A. | CO2通入到 CaCl2溶液中 | |
| B. | NH3通入 AlCl3溶液中 | |
| C. | 用脱脂棉包裹Na2O2粉末向其中通入适量二氧化碳 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体中 |
分析 A.盐酸酸性大于碳酸,CO2通入到 CaCl2溶液中不发生反应;
B.NH3通入 AlCl3溶液中生成氢氧化铝白色沉淀;
C.过氧化钠和二氧化碳气体反应生成碳酸钠和氧气,反应放热脱脂棉燃烧;
D.氢氧化铁胶体中加入电解质溶液,先发生胶体聚沉后沉淀溶解;
解答 解:A.盐酸酸性大于碳酸,CO2通入到 CaCl2溶液中不发生反应,过程中始终无明显现象,故A正确;
B.氢氧化铝是两性氢氧化物溶于强酸强碱,不溶于弱酸弱碱,NH3通入 AlCl3溶液中生成氢氧化铝白色沉淀,Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.过氧化钠和二氧化碳气体反应生成碳酸钠和氧气,反应放热脱脂棉燃烧,有明显现象,故C错误;
D.稀盐酸滴加到Fe(OH)3胶体中,先发生胶体聚沉,继续滴入氢氧化铁沉淀溶解,有明显现象,故D错误;
故选A.
点评 本题考查了物质性质的分析,主要是生成产物和反应现象的判断,注意物质的特殊性掌握,题目较简单.

练习册系列答案
相关题目
11.某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
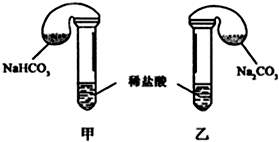
(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+=CO2↑+H2O.
(2)当试管中不再有气体生成时,两组实验出现不同现象,填写下表的空格.

(1)各组反应开始时,甲装置中的气球体积先变大,该装置中反应的离子方程式是HCO3-+H+=CO2↑+H2O.
(2)当试管中不再有气体生成时,两组实验出现不同现象,填写下表的空格.
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
8.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是( )
| A. | 原子半径A>B>D>C | B. | 原子序数a>b>c>d | ||
| C. | 离子半径D>C>B>A | D. | 金属性B>A,非金属性D>C |
5.甲烷的用途很广泛.
(1)已知:
2NO2(g )═N2O4(g)△H=-56.9kJ•mol -1
H2O(g)=H2O(l)△H=-44.0kJ•mol -1
CH4(g)+N2O4 (g)=N2(g)+2H2O(l)+CO2 (g)△H=-898.1kJ•mol -1
则 CH4(g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=-867kJ•mol-1.
(2)一定条件下,发生2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0.在不同时间c(NO)与c(CO)如下表所示:
①该温度下,该反应的平衡常数表达式为K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;
②计算前4秒内氮气的平均反应速率为9.375×10-5mol/(L•s);
③下列选项中,不能说明上述反应已达平衡的是AC
A.2v正(NO)=v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示
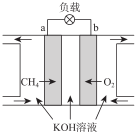
①该燃料电池的正极为b(填“a”或“b”).该电池负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
②放电一段时间后,电解质溶液的pH减小(填“增大”、“减小”或“不变”).
(1)已知:
2NO2(g )═N2O4(g)△H=-56.9kJ•mol -1
H2O(g)=H2O(l)△H=-44.0kJ•mol -1
CH4(g)+N2O4 (g)=N2(g)+2H2O(l)+CO2 (g)△H=-898.1kJ•mol -1
则 CH4(g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=-867kJ•mol-1.
(2)一定条件下,发生2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H<0.在不同时间c(NO)与c(CO)如下表所示:
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
②计算前4秒内氮气的平均反应速率为9.375×10-5mol/(L•s);
③下列选项中,不能说明上述反应已达平衡的是AC
A.2v正(NO)=v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示

①该燃料电池的正极为b(填“a”或“b”).该电池负极的电极反应式为CH4+10OH--8e-=CO32-+7H2O;
②放电一段时间后,电解质溶液的pH减小(填“增大”、“减小”或“不变”).
12.相对分子质量为86的某烃M,其分子中含有4个甲基,则A的一氯代物(不考虑立体异构)最多有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
10.含乙酸钠和对氯酚(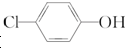 )的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
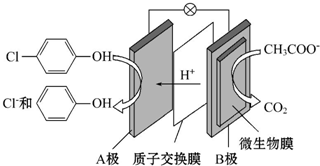
 )的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
| A. | 该装置能将化学能转化为电能 | |
| B. | A极为正极 | |
| C. | B极上发生氧化反应 | |
| D. | 每有1 mol CH3COO-被氧化,就有8 mol电子通过整个电路 |