题目内容
12.相对分子质量为86的某烃M,其分子中含有4个甲基,则A的一氯代物(不考虑立体异构)最多有( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
分析 对分子质量为86的烃是C6H14,先根据分子中含有4个甲基的C6H14的结构简式为(CH3)3CCH2CH3或(CH3)2CHCH(CH3)2,根据等效氢原子的判断方法确定其其一氯代物的同分异构体数目.
解答 解:对分子质量为86的烃是C6H14,分子中含有4个甲基的C6H14的结构简式为(CH3)3CCH2CH3或(CH3)2CHCH(CH3)2,前者含有3种等效氢原子,一氯代物的同分异构体有3种,后者含有2种等效氢原子,一氯代物的同分异构体有2种,所以一氯代物的同分异构体共有5种,故选B.
点评 本题考查同分异构体的书写以及一氯代物数目的判断,注意等效氢原子的寻找方法是关键,难度中等.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
19.下列物质在室温下的溶解度最小的是( )
| A. | 硫酸铵 | B. | 绿矾 | C. | 摩尔盐 | D. | 硫酸 |
3.下列关于物质的检验说法不正确的是( )
| A. | 向某物质中滴加盐酸后,有能使澄清石灰水变浑浊的无色无味气体产生,证明含CO32- | |
| B. | 将某化合物进行焰色实验,透过蓝色钴玻璃观察,焰色为紫色,证明含钾 | |
| C. | 待检液逐滴加入NaOH溶液,有白色胶状沉淀产生,后来沉淀逐渐消失,则原溶液中可能含有Al3+ | |
| D. | 待检液中先加入KSCN溶液,无明显现象,再加入氯水,溶液显血红色,则待检液中一定含有Fe2+ |
20.下列实验过程中,始终无明显现象的是( )
| A. | CO2通入到 CaCl2溶液中 | |
| B. | NH3通入 AlCl3溶液中 | |
| C. | 用脱脂棉包裹Na2O2粉末向其中通入适量二氧化碳 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体中 |
17.短周期主族元素X、Y、Z、W原子序数依次增大,X-与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是( )
| A. | X、Y间可形成离子化合物 | |
| B. | 单质熔点:Y>W>X | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | Y、W形成的单核离子均能破坏水的电离平衡 |
4.在下列各溶液中,离子可能大量共存的是( )
| A. | 无色的碱性溶液中:CrO42-、K+、Na+、SO42- | |
| B. | 含有大量ClO-的溶液中:K+、H+、I-、SO42 | |
| C. | -使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 水电离产生的c(H+)=10-12mol•L-1的溶液中:Na+、Fe2+、SO42-、NO3- |
1. 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
I.制备
称取14.0g CuSOd•5H20、16.0g Na2CO3.10H20,用研钵分别研细后再混合研磨,立即发生反应,有“滋滋”声,而且混合物很快成为“黏胶状”.将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体.
(1)①混合物发生反应时有“滋滋”声的原因是有气体生成.
②检验生成物已洗涤干净的方法是取最后一次洗涤液少许于试管中,加入适量盐酸酸化后滴加氯化钡溶液,若无沉淀生成,则没有SO42-,否则含有SO42-
Ⅱ.组成测定
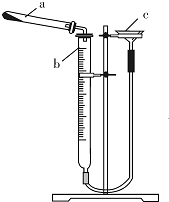
有同学查阅资料发现用Cu(OH)2.CuC03表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2.nCuC03,不同来源的碱式碳酸铜的m、n值需要具体测定.热分解法测定碱式碳酸铜组成的实验装置如图所示.通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值.
(2)①仪器b的名称是碱式滴定管.
②检查装置气密性的方法是连接好装置,通过漏斗向装置中加水,至右侧水面比左侧水面高,静置,水面高度差不发生变化,则装置不 漏气,否则装置漏气.
③三次平行实验测定结果如下表,则该样品中m:n=3:2,若量气管中所盛液体为水,则该测定值比理论值偏大(填“偏大”、“偏小”或“不变”).
III.铜是生命必需的元素,也是人类广泛使用的金属.
(1)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物H2SO4 HCl(填写化学式).
(2)现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜.火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 $\frac{\underline{\;800℃\;}}{\;}$Cu2S+3SO2+2FeO,每转移0.6mol电子,有0.1mol硫被氧化.
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O.
 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.I.制备
称取14.0g CuSOd•5H20、16.0g Na2CO3.10H20,用研钵分别研细后再混合研磨,立即发生反应,有“滋滋”声,而且混合物很快成为“黏胶状”.将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体.
(1)①混合物发生反应时有“滋滋”声的原因是有气体生成.
②检验生成物已洗涤干净的方法是取最后一次洗涤液少许于试管中,加入适量盐酸酸化后滴加氯化钡溶液,若无沉淀生成,则没有SO42-,否则含有SO42-
Ⅱ.组成测定
有同学查阅资料发现用Cu(OH)2.CuC03表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2.nCuC03,不同来源的碱式碳酸铜的m、n值需要具体测定.热分解法测定碱式碳酸铜组成的实验装置如图所示.通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值.
(2)①仪器b的名称是碱式滴定管.
②检查装置气密性的方法是连接好装置,通过漏斗向装置中加水,至右侧水面比左侧水面高,静置,水面高度差不发生变化,则装置不 漏气,否则装置漏气.
③三次平行实验测定结果如下表,则该样品中m:n=3:2,若量气管中所盛液体为水,则该测定值比理论值偏大(填“偏大”、“偏小”或“不变”).
| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
(1)将SO2气体通入CuCl2溶液中,生成CuCl沉淀的同时,还有产物H2SO4 HCl(填写化学式).
(2)现代工业上,主要采用高温冶炼黄铜矿(CuFeS2,也可表示为Cu2S•Fe2S3)的方法获得铜.火法炼铜首先要焙烧黄铜矿:2CuFeS2+4O2 $\frac{\underline{\;800℃\;}}{\;}$Cu2S+3SO2+2FeO,每转移0.6mol电子,有0.1mol硫被氧化.
(3)Cu2O投入足量的某浓度的硝酸中,若所得气体产物为NO和NO2的混合物,且体积比为1﹕1,发生反应的化学方程式为:2Cu2O+10HNO3=4Cu(NO3)2+NO↑+NO2↑+5H2O.
2.2015年10月5日,中国女药学家屠呦呦因从传统中草药里找到了战胜疟疾的新药物--青蒿素(结构简式如图所示),而获得2015年诺贝尔生理学或医学奖,成为第一个获得自然科学领域诺贝尔奖的中国人.下列有关青蒿素的叙述正确的是( ) 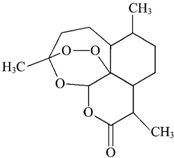

| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 该有机物属于烃 | |
| C. | 分子中含有醚键、酯基、甲基三种官能团 | |
| D. | 能发生加成反应和取代反应 |


 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式 (其中之一);
(其中之一); ;
; .
.