题目内容
6.由铜片、铁片和50mL稀硫酸组成的原电池中,当通过导线的电子为0.3mol时(铁片上无气体产生),硫酸恰好反应完.列式计算:(1)产生这些气体消耗的金属是哪一种,消耗的质量是多少;
(2)铜片上放出多少L(标准状况)气体;
(3)硫酸溶液的物质的量浓度是多少.
分析 (1)根据化学方程式Fe+H2SO4=FeSO4+H2↑中气体与锌的关系计算;
(2)根据氢气与电子的关系式计算;
(3)根据氢气与硫酸的关系计算硫酸的物质的量,再根据物质的量浓度公式计算其浓度.
解答 解:(1)铁作负极,设铁片的质量减少了x,
Fe+H2SO4=FeSO4+H2↑~2mole-
56g 2mol
x 0.3mol
所以 x=8.4g,
答:消耗的金属是铁,消耗的质量8.4g;
(2)铜片为正极,设铜片上放出yL(标准状况)气体发生的电极方程式为:
2H++2e-=H2↑
2mol 22.4L
0.3mol y
y=3.36L,
答:铜片上放出3.36L(标准状况)气体;
(3)设硫酸的物质的量为z.
Fe+H2SO4=FeSO4+H2↑
1mol 22.4L
z 3.36L
所以z=0.15mol
C=$\frac{n}{V}$=$\frac{0.15}{0.05}$=3mol/L
答:原稀硫酸溶液的物质的量浓度3mol/L.
点评 本题以原电池为载体考查了氧化还原反应的有关计算,明确各物理量间的关系是解本题的关键.

练习册系列答案
相关题目
14.已知芳香烃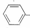 一R能被酸性 KMn04溶液氧化生成
一R能被酸性 KMn04溶液氧化生成 一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为
一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为 一C00H 的同分异构体数目为( )
一C00H 的同分异构体数目为( )
 一R能被酸性 KMn04溶液氧化生成
一R能被酸性 KMn04溶液氧化生成 一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为
一C00H,但若烷基 R中直接与苯环相连的碳原子上没有 C-H键,则不能被氧化得到一C00H. 现有分子式为 C11H16的一烷基取代苯,则它可以被氧化成为 一C00H 的同分异构体数目为( )
一C00H 的同分异构体数目为( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
11.以下对核外电子运动状况描述正确的是( )
| A. | 能量低的电子只能在s轨道上运动,能量高的电子总在f轨道上运动 | |
| B. | 电子的运动和行星相似,围绕着原子核在固定的轨道上高速旋转 | |
| C. | 同一能层中不同能级的能量高低相同 | |
| D. | M能层中含有3d能级 |
18.下列说法正确的是( )
| A. | ${\;}_{53}^{135}$I位于元素周期表中第4周期ⅦA族 | |
| B. | ⅦA族氢化物的沸点:HF<HCl<HBr<HI | |
| C. | ${\;}_{53}^{135}$I核内的中子数与核外电子数之差为29 | |
| D. | ${\;}_{53}^{135}$I2和${\;}_{53}^{131}$I2是碘的两种同位素 |
15.W、X、Y、Z均为短周期元素,原子序数依次增加,W的原子核最外层电子数是次外层的2倍,X-、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应.下列说法正确的是( )
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:X>Z>W | |
| C. | 最高价氧化物的水化物的酸性:W>Z | |
| D. | X可分别与W、Y形成化合物,其所含的化学键类型相同 |
16.某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
I.合成苯甲酸甲酯粗产品
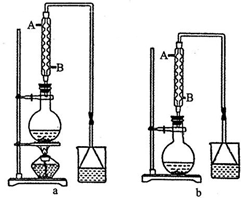
(1)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.
(2)实验中浓硫酸的作用是催化剂、吸水剂冷凝水应从b(填“a”或“b”,下同)口进,a口出.
(3)反应物CH3OH应过量,理由是为了提高苯甲酸甲酯的产率;两套装置中导管末端均没有伸入到试管液面以下的原因防止倒吸.
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图丙中方括号内填入操作方法的名称.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
(1)甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点,最好采用甲(填“甲”或“乙”)装置.理由是甲中有冷凝回流装置.

(2)实验中浓硫酸的作用是催化剂、吸水剂冷凝水应从b(填“a”或“b”,下同)口进,a口出.
(3)反应物CH3OH应过量,理由是为了提高苯甲酸甲酯的产率;两套装置中导管末端均没有伸入到试管液面以下的原因防止倒吸.
Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图丙中方括号内填入操作方法的名称.
 实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题.
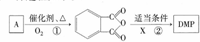
实验室可用NaBr、浓H2SO4和乙醇为原料制备溴乙烷.已知反应物的用量为:0.30 mol NaBr(s);0.25 mol 乙醇(密度为0.80g•cm-1);36 mL浓硫酸(溶质的质量分数为98%,密度为1.84 g•mL-1);25 mL水.回答下列问题. )是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示:
)是一种酯类塑化剂,DMP的蒸气对氢气的相对密度为97.工业上生产 DMP的工艺流程如图所示: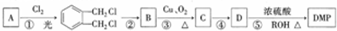
 .
. .
.