题目内容
6.镁是一种很活泼的金属,常用作脱硫剂、脱氧剂.在电子工业中利用镁制取硅的反应为:2Mg+SiO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+Si;同时有副反应发生:2Mg+Si$\frac{\underline{\;\;△\;\;}}{\;}$Mg2Si已知:Mg2Si遇盐酸迅速反应生成SiH4(硅烷)
SiH4在常温下是一种不稳定的气体,且易燃
镁与SO2可发生类似于镁与CO2的反应

Ⅰ.图(甲)是进行Mg与SiO2反应的实验装置.
(1)由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气.X气体应选用①CO2、②N2、③H2中的③
(2)实验开始时,必须先通入X的气体,再接通电源加热反应物,其理由是防止加热条件下H2与空气混合爆炸;当反应引发后,切断电源,反应能继续进行,其原因是
Mg与SiO2的反应是放热反应
(3)反应结束时,待冷却至常温后,关闭K,从分液漏斗处加入稀盐酸,可观察到导管口a处有闪亮的火星.据此现象可推知SiH4在空气中能自燃.
Ⅱ.图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质.实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的H2S气体生成.
(1)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯.橡胶气胆B在实验中的作用是防止C管降温时因气体压强减小,而引起D中溶液倒流
(2)C中全部反应产物有MgO、S、MgS.(填化学式)
分析 Ⅰ.(1)Mg可以与CO2、N2发生化学反应,Mg与氢气不能发生反应;
(2)不纯的氢气燃烧会发生爆炸;Mg与SiO2反应的条件是加热,切断电源后,反应的条件由反应放热维持;
(3)反应生成的Mg2Si遇盐酸迅速反应生成SiH4(硅烷),观察到导管口a处有闪亮的火星,说明有气体在空气中自燃;
Ⅱ.(1)打开K,将空气充入反应反应体系,可平衡容器内外压强,防止倒吸;
(2)浓硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫与Mg反应,生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS.根据元素守恒可知,另外一种产物为氧化镁.
解答 解:(1)Mg可以与CO2、N2发生化学反应,3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$Mg3N2、2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,Mg与氢气不能发生反应,因此可用氢气作为保护气,故选③;
(2)装置中有空气,若不用氢气排空装置中的空气,氢气和空气的混合气体燃烧会发生爆炸;Mg与SiO2反应的条件是加热,切断电源后,反应的条件由反应放热维持,
故答案为:防止加热条件下H2与空气混合爆炸;Mg与SiO2的反应是放热反应;
(3)Mg2Si遇盐酸迅速反应生成SiH4(硅烷),其反应的方程式为:Mg2Si+4HCI=2MgCl2+SiH4↑,观察到导管口a处有闪亮的火星,说明有气体在空气中自燃,即SiH4在空气中自燃;
故答案为:SiH4;
Ⅱ.(1)停止实验后,温度降低导致体系内部压强减小,容易发生倒吸,打开K,将空气充入反应反应体系,可平衡容器内外压强,防止倒吸,
故答案为:防止C管降温时因气体压强减小,而引起D中溶液倒流;
(2)浓硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫与Mg反应,生成淡黄色固体S,臭鸡蛋气味的气体为硫化氢,因此二氧化硫与Mg反应产物为MgS.根据元素守恒可知,另外一种产物为MgO,
故答案为:MgO、S、MgS.
点评 本题考查了物质实验室制备原理和装置选择,实验步骤的设计分析判断,物质性质的应用是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案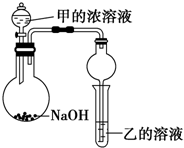 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.(2)关于Y、Z两种元素,下列叙述正确的是b(填序号)
a.简单离子的半径Y>Z b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.
某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是把浓氨水滴到NaOH固体上,NaOH固体可吸收水,并且溶液中OH-浓度增大,可使平衡NH3+H2O?NH3•H2O?NH4++OH-向左移动,且过程中放热,故有利于NH3放出.一段时间后,观察到试管中的现象是生成白色沉淀,发生反应的离子方程式是3NH3.H2O+Al3+=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH═M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
| A. | 标准状况下,22.4LHF中含有的分子数目为NA | |
| B. | .1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA | |
| C. | .标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | .5.6gFe在0.1molCl2中充分燃烧,转移的电子数目为0.2NA |
| A. | HCl→H2 | B. | H2O2→O2 | C. | H2SO4→SO2 | D. | Fe→Fe3O4 |
| A. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 | |
| B. | PM2.5表面积大,能吸附大量的有毒、有害物质 | |
| C. | 高纯硅在太阳能电池及信息高速传输中有重要应用 | |
| D. | 从海水中提取物质不一定要通过化学反应实现 |
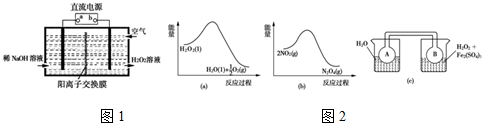
(1)空气阴极法电解制备H2O2的装置如图1所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物.试回答:
①直流电源的a极名称是正极.
②阴极电极反应式为O2+2e-+2H2O=H2O2+2OH-.
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2.相对于电解法,该方法具有的优点是安全、能耗低.
(2)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动.
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜.反应的离子方程式是Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O,控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
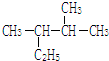 用系统命名法命名:2,3-二甲基戊烷;
用系统命名法命名:2,3-二甲基戊烷;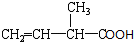 含氧官能团的名称是羧基;
含氧官能团的名称是羧基;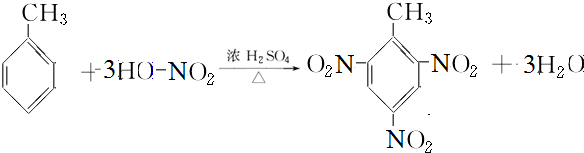 ;
; ;
;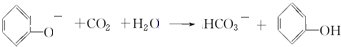 .
.