题目内容
7.化学与生产、生活密切相关.下列说法不正确的是( )| A. | 闻名世界的中国陶瓷、酿酒等技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 打磨磁石制作指南针为化学变化 |
分析 A.陶瓷、酿酒、造纸都发生了化学变化;
B.根据黑火药的成分分析;
C.侯氏制碱法中生成了溶解度较小的碳酸氢钠;
D.打磨磁石制指南针没有新物质生成.
解答 解:A.陶瓷、酿酒、造纸等工艺过程中都发生了化学变化,充分应用了化学工艺,故A正确;
B.黑火药的成分是硫磺、硝石和木炭,三者按照1:2:3的组成混合在一起,故B正确;
C.侯氏制碱法是用饱和的氯化钠溶液中通入氨气和二氧化碳,反应生成了溶解度较小的碳酸氢钠,故C正确;
D.打磨磁石制指南针没有新物质生成,故是物理变化,不是化学变化,故D错误.
故选D.
点评 本题考查了化学知识在生产生活中的应用,题目难度不大,侧重于基础知识的考查,注意学习时理论联系实际.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
2.在碱性溶液中能大量共存并且溶液为无色透明的离子组是( )
| A. | K+、MnO4-、Na+、Cl- | B. | Na+、NO3-、H+、SO42- | ||
| C. | K+、NO3-、Na+、CO32- | D. | Na+、HCO3-、Cl-、SO42- |
2.物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
| A. | Ba(OH)2、Na2S03、FeCl3、KCl | B. | Na2Si03、Na2C03、KN03、NH4Cl | ||
| C. | NH3、H20、H3P04、Na2S04、H2S04 | D. | HCl、CH2COOH、C2H5OH、Na2SiO3 |
12.0.12mol/L的NaCl、MgCl2、AlCl3三种溶液500mL中Cl-的物质的量浓度( )
| A. | 相同 | |
| B. | 无法比较 | |
| C. | 依次为0.12mol/L、0.24mol/L、0.36mol/L | |
| D. | 依次为0.06mol/L、0.12mol/L、0.18mol/L |
19.在强酸性溶液中能大量共存的透明离子组是( )
| A. | K+ Na+ NO3- CO32- | B. | Na十 Fe3+ SCN- SO42- | ||
| C. | K+ Na十 Cl- AlO2- | D. | Al3+ Na+ Cl- SO42- |
16.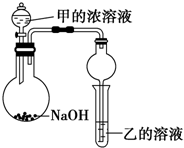 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:
(1)Z离子的结构示意图为 .
.
(2)关于Y、Z两种元素,下列叙述正确的是b(填序号)
a.简单离子的半径Y>Z b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.
某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是把浓氨水滴到NaOH固体上,NaOH固体可吸收水,并且溶液中OH-浓度增大,可使平衡NH3+H2O?NH3•H2O?NH4++OH-向左移动,且过程中放热,故有利于NH3放出.一段时间后,观察到试管中的现象是生成白色沉淀,发生反应的离子方程式是3NH3.H2O+Al3+=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH═M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素 | T | X | Y | Z | W |
| 原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.(2)关于Y、Z两种元素,下列叙述正确的是b(填序号)
a.简单离子的半径Y>Z b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.
某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是把浓氨水滴到NaOH固体上,NaOH固体可吸收水,并且溶液中OH-浓度增大,可使平衡NH3+H2O?NH3•H2O?NH4++OH-向左移动,且过程中放热,故有利于NH3放出.一段时间后,观察到试管中的现象是生成白色沉淀,发生反应的离子方程式是3NH3.H2O+Al3+=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一.它被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH═M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
17.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4LHF中含有的分子数目为NA | |
| B. | .1 L 0.1mol/L 的FeCl3溶液中,Fe3+的数目为0.1NA | |
| C. | .标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA | |
| D. | .5.6gFe在0.1molCl2中充分燃烧,转移的电子数目为0.2NA |