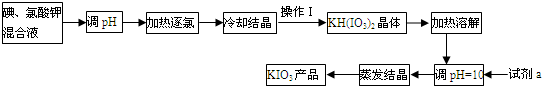
题目内容
某二元弱酸的酸式盐NaHA溶液,若pH<7,则溶液中各粒子的浓度关系不正确的是( )
| A、c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A) |
| B、c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) |
| C、c(H+)+c(A2-)=c(OH-)+c(H2A) |
| D、c(Na+)=c(HA-)+c(H2A)+c(A2-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:某二元弱酸的酸式盐NaHA溶液,若pH<7,说明溶液呈酸性,弱酸阴离子电离大于水解,结合溶液中离子浓度大小,电荷守恒,物料守恒分析判断选项
解答:
解:某二元弱酸的酸式盐NaHA溶液,若pH<7,说明溶液呈酸性,弱酸阴离子电离大于水解;
A、溶液中HA-离子电离大于水解,离子浓度大小为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A),故A正确;
B、溶液中存在电荷守恒c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故B正确;
C、溶液中存在电荷守恒c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),物料守恒:c(Na+)=c(HA-)+c(H2A)+c(A2-),合并得到:
c(H+)+c(H2A)=c(OH-)+c(A2-),故C错误;
D、溶液中存在物料守恒:c(Na+)=c(HA-)+c(H2A)+c(A2-),故D正确;
故选C.
A、溶液中HA-离子电离大于水解,离子浓度大小为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A),故A正确;
B、溶液中存在电荷守恒c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故B正确;
C、溶液中存在电荷守恒c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),物料守恒:c(Na+)=c(HA-)+c(H2A)+c(A2-),合并得到:
c(H+)+c(H2A)=c(OH-)+c(A2-),故C错误;
D、溶液中存在物料守恒:c(Na+)=c(HA-)+c(H2A)+c(A2-),故D正确;
故选C.
点评:本题考查了电解质溶液中离子浓度大小分析,电荷守恒、物料守恒的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法不正确的是( )
A、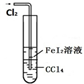 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
B、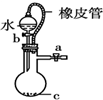 橡皮管的作用是使水能顺利流下 |
C、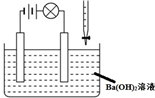 若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮 |
D、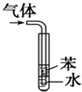 用于吸收HCl气体能防倒吸 |
下列物质的检验,其结论一定正确的是( )
| A、向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- |
| B、向某溶液中加盐酸产生无色气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32-或SO32- |
| C、取少量久置的Na2SO3样品于试管中加水溶解,再加盐酸酸化,然后加BaCl2溶液,若加HCl时有气体产生,加BaCl2时有白色沉淀产生,说明Na2SO3样品已部分被氧化 |
| D、能使湿润的碘化钾淀粉试纸变蓝的一定是Cl2 |
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉.对加入铁粉充分反应后的溶液分析合理的是( )
| A、若无固体剩余,则溶液中一定有Fe3+ |
| B、若溶液中有Cu2+,则一定没有固体析出 |
| C、若有固体存在,则溶液中一定有Fe2+ |
| D、若溶液中有Fe2+,则一定有Cu析出 |
下列实验操作中和事故、药品的处理中正确的是( )
| A、“粗盐提纯“的实验中,当蒸发皿中出现较多固体时,停止加热 |
| B、少量浓硫酸沾在皮肤上立即用氢氧化钠冲洗 |
| C、有腐蚀性D的药品直接放在天平托盘上称重 |
| D、提取溴水中的溴时,可以选择酒精灯、作萃取剂 |
下列有机物属于烃类的是( )
| A、CH3COOH |
| B、CH2═CH2 |
| C、CH3COOCH2CH3 |
| D、CH3CH2OH |