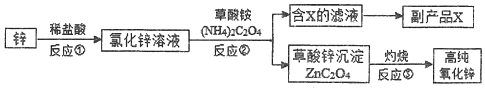
题目内容
5.海带中含有丰富的碘元素,实验室从海带中提取碘的流程如图: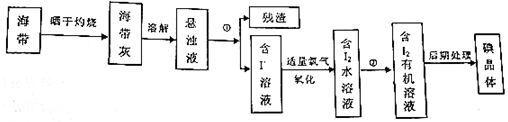
(1)将海带灼烧的目的是除去杂质有机物等物质获得碘离子;
(2)指出有关实验的操作名称:①过滤,②萃取分液;
(3)在提取碘的过程中可供选择的萃取剂是B.
A.酒精 B.四氯化碳 C.碘化钾溶液 D.氯化钠溶液.
分析 实验室从海带中提取碘:海带灼烧成灰,浸泡溶解得到海带灰悬浊液,通过①过滤,得到不溶的残渣,滤液为含碘离子的溶液,加入氧化剂,将碘离子氧化成碘单质,②利用有机溶剂萃取出碘单质,再通过蒸馏提取出碘单质,
(1)海带的主要成分是纤维素等有机物,故灼烧可以除去这些有机物,从而获得碘离子;
(2)分离难溶性固体和溶液采用过滤的方法,分离互不相溶的液体采用分液方法;
(3)萃取剂的选取标准:和原溶剂不互溶,溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,萃取剂和溶质不反应.
解答 解:(1)将海带灼烧的目的是除去杂质有机物等物质获得碘离子,
故答案为:除去杂质有机物等物质获得碘离子;
(2)①分离难溶性固体和溶液采用过滤的方法,海藻灰难溶于水,碘离子易属于水,所以该操作为过滤,②碘在有机溶剂中的溶解度大于在水溶液中的溶解度,所以可以采用萃取的方法萃取出碘水中的碘,然后采用分液的方法分离,故答案为:过滤;萃取分液;
(3)碘易溶于四氯化碳和苯,且四氯化碳和苯都符合萃取剂选取标准,所以可以用四氯化碳或苯作萃取剂,如果选四氯化碳作萃取剂,四氯化碳密度大于水,所以有机层在下方,且溶液呈紫红色,酒精易溶于水不能做萃取剂,碘化钾溶液和氯化钠溶液不能做萃取剂,故选B,
故答案为:B.
点评 本题考查海水资源综合利用,侧重考查混合物的分离和提纯、实验基本操作能力的考查,明确物质的性质及实验操作规范性是解本题关键,知道常见混合物分离和提纯方法及选取方法,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
相关题目
15.对于amolH2O和amolCO2的说法正确的是( )
| A. | 质量比是9:22 | B. | 相同条件下的密度一定相同 | ||
| C. | 原子个数不同 | D. | 相同条件下体积一定相同 |
16.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的CO在加热下还原相同质量的混合物,最终得到铁的物质的量为( )
| A. | 0.24mol | B. | 0.21mol | C. | 0.25mol | D. | 0.12mol |
20.在一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应:C(s)+2H2O(g)?CO2(g)+2H2(g),其相关数据如表所示:
(1)T1>T2(填“>”、“<”或“=”)
(2)达到平衡后,保持温度和体积不变,向甲容器内再充入0.8molH2O和3.2molH2,则此时V正=V逆
(填“>”、“<”或“=”)
(3)在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)═2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
(4)某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:
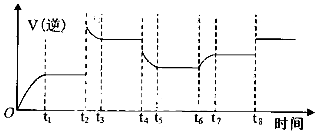
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,(填“t1~t2,以此类推”).
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3.0 |
(2)达到平衡后,保持温度和体积不变,向甲容器内再充入0.8molH2O和3.2molH2,则此时V正=V逆
(填“>”、“<”或“=”)
(3)在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是BD.
A.V逆(CO2)═2V正(H2)
B.混合气体的密度保持不变
C.c(H2O):c(CO2):c(H2)=2:1:2
D.混合气体的平均相对分子质量保持不变
(4)某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示:

可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则t6时刻改变的条件是通入H2O,则从t1到t8哪个时间段H2O (g)的平衡转化率最低t7-t8,(填“t1~t2,以此类推”).
2.NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 0.1molC2H6O分子中含有C-H键数为0.5NA | |
| B. | 0.1molCl2和0.1molHI充分反应后气体分子数为0.2NA | |
| C. | CO2通过Na2O2使其增重2.8g,反应中转移电子数为0.2NA | |
| D. | 3.Og甲醛(HCHO)和乙酸的混合物中含有的原子总数为0.4NA |
9.饱和氨水溶液中存在化学平衡和电离平衡:NH3+H2O?NH3•H2O?NH4++OH-.下列有关说法正确的是( )
| A. | 常温下饱和氨水的pH<7 | |
| B. | 向氨水中滴加过量硫酸,所有平衡均向正向移动,pH增大 | |
| C. | 电离是吸热反应,升高温度,所有平衡均正向移动 | |
| D. | 向氨水中加入少量NaOH固体,所有平衡均逆向移动,有NH3放出 |
7.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 23 g钠与足量氧气充分反应,转移的电子个数为NA | |
| B. | 1mol Cl2与水充分反应,转移的电子个数为NA | |
| C. | 1mol Na2O2与水完全反应时转移电子数为2NA | |
| D. | 18 g H2O含有的电子数为18NA |