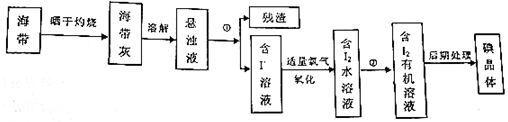
题目内容
15.对于amolH2O和amolCO2的说法正确的是( )| A. | 质量比是9:22 | B. | 相同条件下的密度一定相同 | ||
| C. | 原子个数不同 | D. | 相同条件下体积一定相同 |
分析 根据m=nM,V=nVm,$ρ=\frac{m}{V}$,结合分子构成计算.
解答 解:A.amolH2O和amolCO2的质量比是18a:44a=9:22,故A正确;
B.相同条件下的密度之比等于摩尔质量之比,所以密度一定不相同,故B错误;
C.amolH2O中含有3amol原子,amolCO2中含有3amol原子,原子个数相同,故C错误;
D.在标准状况下,水为液体,所以amolH2O和amolCO2的体积不相同,故D错误.
故选A.
点评 本题考查物质的量的计算、阿伏加德罗定律及推论,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意物质的量与体积、原子数目的计算公式的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法正确的是( )
| A. | 煤、石油是不可再生能源,天然气是可再生能源 | |
| B. | 在化学反应中,反应物转化为生成物的同时,必然发生能量的变化 | |
| C. | 热值指在一定条件下,1mol的物质完全燃烧所放出的热量 | |
| D. | 若化学过程中断开化学键放出的能量大于形成化学键所吸收的能量,则反应放热 |
7. 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意使气体冷却至室温,量气管中的液面与漏斗中的液面要相平齐若考虑分液漏斗滴入烧瓶中液体的体积(假设其它操作都正确),则测得气体的体积将无影响(填“偏大”、“偏小”或“无影响”).
(2)若在烧瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀.
①通过分液漏斗向烧瓶中加入的试剂可选用下列ac(填序号)
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是量气管液面会下降.
(3)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度.你认为此方法是否可行不可行,铜与稀硝酸反应生成的NO会与空气的氧气反应生成二氧化氮,进而与水生成硝酸,会影响NO的体积的测定(填“可行”或“不可行”,若填“不可行”请说明原因).
(4)为探究MnO2在H2O2制取O2过程中的作用,将等量的H2O2加入烧瓶中,分别进行2次实验(气体体积在同一状况下测定):
若实验1中MnO2的作用是催化剂,则实验2中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、H2O2+MnO2+H2SO4=2H2O+O2↑+MnSO4.
(5)若烧瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
则镁铝合金中镁的质量分数为73%.
 某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:
某兴趣小组的同学设计了如图装置进行试验探究,请回答下列问题:(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处向平,还应注意使气体冷却至室温,量气管中的液面与漏斗中的液面要相平齐若考虑分液漏斗滴入烧瓶中液体的体积(假设其它操作都正确),则测得气体的体积将无影响(填“偏大”、“偏小”或“无影响”).
(2)若在烧瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀.
①通过分液漏斗向烧瓶中加入的试剂可选用下列ac(填序号)
a.NaOH溶液 b.C2H5OH c.NaCl溶液 d.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是量气管液面会下降.
(3)若烧瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度.你认为此方法是否可行不可行,铜与稀硝酸反应生成的NO会与空气的氧气反应生成二氧化氮,进而与水生成硝酸,会影响NO的体积的测定(填“可行”或“不可行”,若填“不可行”请说明原因).
(4)为探究MnO2在H2O2制取O2过程中的作用,将等量的H2O2加入烧瓶中,分别进行2次实验(气体体积在同一状况下测定):
| 序号 | 烧瓶中的物质 | 测得气体体积 |
| 实验1 | 20mL H2O2,足量MnO2 | V1 |
| 实验2 | 20mL H2O2,足量MnO2和稀硫酸 | V1<V2<2V1 |
(5)若烧瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
| 编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
| Ⅰ | 1.0g | 10.00mL | 346.30mL |
| Ⅱ | 1.0g | 10.00mL | 335.50mL |
| Ⅲ | 1.0 g | 10.00mL | 346.00mL |
| Ⅳ | 1.0g | 10.00mL | 345.70mL |
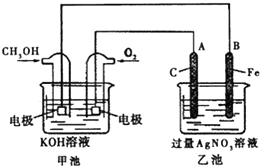 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中的信息,填写空格.

 ;E→F的反应类型取代反应
;E→F的反应类型取代反应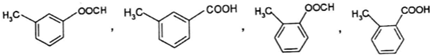 (其中一种).
(其中一种). 和苯环结构;
和苯环结构; .
. )的合成路线(用流程图表示;无机试剂任选).
)的合成路线(用流程图表示;无机试剂任选).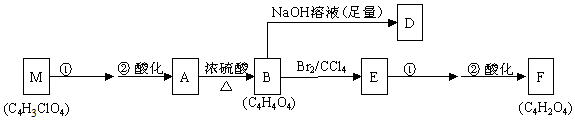
 +(2n-1)H2O .
+(2n-1)H2O . .
.