题目内容
14.下列说法正确的是( )| A. | 0.1 mol•L-1的醋酸加水稀释,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 | |
| C. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量)后者用时少 | |
| D. | 常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,溶液显碱性 |
分析 A.醋酸稀释,电离平衡正向移动,醋酸的物质的量减小、醋酸根离子的物质的量增大;
B.Kw与温度有关;
B.体积、pH均相同的醋酸和盐酸,醋酸浓度大;
D.常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,醋酸浓度大,反应后为醋酸钠和醋酸的混合溶液.
解答 解:A.醋酸稀释,电离平衡正向移动,醋酸的物质的量减小、醋酸根离子的物质的量增大,则$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小,故A正确;
B.Kw与温度有关,则向水中加入少量固体硫酸氢钠,c(H+)增大,但Kw不变,故B错误;
B.体积、pH均相同的醋酸和盐酸,醋酸浓度大,则完全溶解等量的镁粉(少量)前者反应速率大、用时少,故C错误;
D.常温下,pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合,醋酸浓度大,反应后为醋酸钠和醋酸的混合溶液,则溶液显酸性,故D错误;
故选A.
点评 本题考查弱电解质的电离平衡,为高频考点,把握电离平衡移动、pH与浓度的关系、酸碱混合为解答的关键,侧重分析与应用能力的考查,注意选项D中反应后溶质的判断,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
4.下列有关化学用语表达正确的是( )
| A. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| B. | 硫酸的电离方程式:H2SO4═H22++SO42- | |
| C. | HF的电子式: | |
| D. | 35Cl-和37Cl-离子结构示意图均可以表示为: |
2.下列物质中,有非极性键的是( )
| A. | 氮气 | B. | 氯化镁 | C. | 水 | D. | 甲烷 |
19.下列离子方程式错误的是( )
| A. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| B. | 氯气与氢氧化钾溶液反应:Cl2+OH-═Cl-+ClO-+2H2O | |
| C. | 硫酸铝与氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 小苏打溶液与稀盐酸反应:HCO3-+H+═H2O+CO2↑ |
1.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法正确的是(m、n 均为正整数)( )
| A. | 离子半径:Rn+>Zm- | |
| B. | 若Y的最高价氧化物对应的水化物HnY0m为强酸,则X的氢化物沸点一定比Y的氢化物的沸点低 | |
| C. | 若X的气态氢化物能使湿润的石蕊试纸变蓝,则标准状况下,18g Y的氢化物的体积为2.24 L | |
| D. | 若R(OH)n为弱电解质,则W(OH)n+1可与KOH溶液反应 |
18.下列说法正确的( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中只能含离子键 | |
| D. | 只有非金属原子间才能形成共价键 |
19.某元素的原子最外层有2个电子,则这种元素是( )
| A. | 金属元素 | B. | 惰性气体元素 | C. | 第二主族元素 | D. | 以上叙述都可能 |

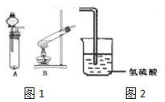 某研究性学习小组设计了一组实验来验证元素周期律.
某研究性学习小组设计了一组实验来验证元素周期律.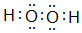 ;
;