题目内容
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀.(此转化关系中所用的试剂都是足量的)
(1)写出下列物质的化学式:F ,G .
(2)将混合物中两种金属分离开的最简单的方法是 .
(3)写出离子方程式:A→C: . D→E: .
(4)①常用来检验G中阳离子的方法是 .②J的用途有 、 .

(1)写出下列物质的化学式:F
(2)将混合物中两种金属分离开的最简单的方法是
(3)写出离子方程式:A→C:
(4)①常用来检验G中阳离子的方法是
考点:无机物的推断
专题:推断题
分析:I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe,J为Fe2O3;金属A能与盐酸、氢氧化钠溶液反应,A为计算Al;E为白色沉淀,为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3.
解答:
解:I为红褐色沉淀,为Fe(OH)3,由转化关系可知,H为Fe(OH)2,G为FeCl2,B为Fe,J为Fe2O3;金属A能与盐酸、氢氧化钠溶液反应,A为金属Al,E为白色沉淀,为Al(OH)3,由转化关系可知,D为AlCl3,X为碱或水解为碱性的物质,F为Al2O3,
(1)由上述分析可知,F为Al2O3,G为FeCl2;
故答案为:Al2O3,FeCl2;
(2)混合物为铁与铝,铁具有磁性,可以利用磁铁吸出铁进行分离;
故答案为:利用磁铁吸出铁;
(3)A→C为铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
D→E的转化为AlCl3→Al(OH)3,X为碱或水解为碱性的物质,加入过量的X,X不能是强碱,故X可能是氨水(或碳酸钠、碳酸氢钠、偏铝酸钠)等,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(4)①常用来检验G中阳离子的方法是,取少量溶液与试管中,滴入硫氰酸钾溶液,无现象,再滴入氯水后溶液变化为红色溶液,证明原溶液中含有亚铁离子;
故答案为:取少量溶液与试管中,滴入硫氰酸钾溶液,无现象,再滴入氯水后溶液变化为红色溶液,证明原溶液中含有亚铁离子;
②J为Fe2O3,依据氧化铁的性质和用途分析,主要用于冶炼金属铁,制红色防锈油漆,塑料制品的着色等;
故答案为:冶炼金属铁,制红色防锈油漆;
(1)由上述分析可知,F为Al2O3,G为FeCl2;
故答案为:Al2O3,FeCl2;
(2)混合物为铁与铝,铁具有磁性,可以利用磁铁吸出铁进行分离;
故答案为:利用磁铁吸出铁;
(3)A→C为铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
D→E的转化为AlCl3→Al(OH)3,X为碱或水解为碱性的物质,加入过量的X,X不能是强碱,故X可能是氨水(或碳酸钠、碳酸氢钠、偏铝酸钠)等,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(4)①常用来检验G中阳离子的方法是,取少量溶液与试管中,滴入硫氰酸钾溶液,无现象,再滴入氯水后溶液变化为红色溶液,证明原溶液中含有亚铁离子;
故答案为:取少量溶液与试管中,滴入硫氰酸钾溶液,无现象,再滴入氯水后溶液变化为红色溶液,证明原溶液中含有亚铁离子;
②J为Fe2O3,依据氧化铁的性质和用途分析,主要用于冶炼金属铁,制红色防锈油漆,塑料制品的着色等;
故答案为:冶炼金属铁,制红色防锈油漆;
点评:以“无机框图题”的形式考查元素单质及其化合物的性质,涉及常用化学用语等,难度中等,在熟练掌握元素化合物知识的基础上着重考查学生的发散思维、分析判断、逻辑思维以及对无机物知识的综合应用等能力,I的颜色及金属A能与盐酸、氢氧化钠溶液反应是推断突破口.

练习册系列答案
相关题目
下列说法正确的是( )
①原子序数为15的元素的最高化合价为+5
②ⅦA族元素的最高正价是同周期中元素中最大的
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④ⅢB族元素种类最多
⑤M层电子数等于内层电子数之和的
的原子一定是ⅡA族元素
⑥由离子X+推测,X可能为过渡元素.
①原子序数为15的元素的最高化合价为+5
②ⅦA族元素的最高正价是同周期中元素中最大的
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④ⅢB族元素种类最多
⑤M层电子数等于内层电子数之和的
| 1 |
| 5 |
⑥由离子X+推测,X可能为过渡元素.
| A、①②④ | B、①④⑤ |
| C、②④⑥ | D、③④⑤ |
当反应条件(如温度,浓度,物质的量的多少)改变时,下列不会引起生成改变的是( )
| A、钠和氧气 |
| B、锌和硫酸 |
| C、氢气和氯气 |
| D、偏铝酸钠溶液和二氧化碳 |
下列说法正确的是( )
| A、草酸氢钾溶液呈酸性,在0.1mol?L-1 KHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| B、在小苏打水溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| C、相同温度下,1mol?L-1氨水溶液与0.5mol?L-1氨水溶液中,c(OH-)之比是2:1 |
| D、当氨水与盐酸恰好完全反应时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
某地污水中含有Zn2+、Fe3+和Cu2+ 三种阳离子.甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:(已知:Zn(OH)2+2OH-═ZnO22-+2H2O)
甲:污水
沉淀
CuO
Cu
乙:污水
滤渣
CuO
Cu
丙:污水
滤渣
滤渣
CuO
Cu
下列判断正确的是( )
甲:污水
| +NaOH溶液,过滤 |
| ① |
| △ |
| ② |
| +H2△ |
| ③ |
乙:污水
| +过量铁粉,过滤 |
| ① |
| △ |
| ② |
| +H2△ |
| ③ |
丙:污水
| +过量铁粉,过滤 |
| ① |
| +稀盐酸,过滤 |
| ② |
| △ |
| ③ |
| +H2,△ |
| ④ |
下列判断正确的是( )
| A、丙方案回收铜较好,但也发生环境污染 |
| B、乙方案中加过量铁粉可以将三种阳离子全部还原 |
| C、甲方案中的反应涉及置换、分解、化合、复分解四种反应类型 |
| D、三种实验方案中都能制得纯净铜 |
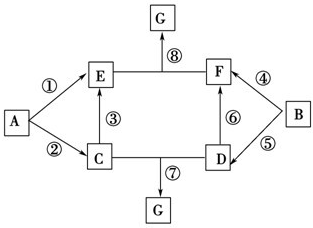 A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).
A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).