题目内容
2.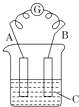 如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.(1)B为原电池的负极,金属活泼性:A<B(填“>”或“<”);若电极有:Zn、Fe、Cu、Ag四种金属棒,且已知B为Cu,则A为Ag.
(2)若电解质溶液有稀H2SO4和AgNO3溶液,则C应为AgNO3溶液.
分析 A极逐渐变粗,B极逐渐变细,负极变细说明负极是金属,正极变粗说明有金属析出,电流计指针会偏转说明有电流通过,即该装置构成了原电池装置,据此分析.
解答 解:(1)因为负极变细说明负极是金属,正极变粗说明有金属析出,所以A极逐渐变粗,B极逐渐变细,所以B为原电池的负极,金属活泼性:A<B;若电极有:Zn、Fe、Cu、Ag四种金属棒,且已知B为Cu,则A为Ag,故答案为:负;<;Ag;
(2)正极变粗说明有金属析出,所以若电解质溶液有稀H2SO4和AgNO3溶液,则C应为AgNO3溶液,故答案为:AgNO3溶液.
点评 本题考查原电池装置及工作原理,熟悉金属的活泼性及发生的氧化还原反应是解答本题的关键,较为基础.

练习册系列答案
相关题目
17.汽车安全气囊碰撞时会发生如下反应:10NaN3+2KNO3=5Na2O+X+16N2↑,则下列说法正确的是( )
| A. | X的化学式为:K2O2 | B. | KNO3发生氧化反应 | ||
| C. | NaN3的电子式为 | D. | 氧化产物与还原产物质量比为1:15 |
7.下列说法中正确的是( )
| A. | 用到金属钠时,要用镊子取、再用小刀切下所需量,剩余的钠不能放回原试剂瓶中 | |
| B. | 大型中央空调的制冷剂可用液氨 | |
| C. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 | |
| D. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
11.下列说法中正确的是( )
| A. | H3PO4的摩尔质量为98 | |
| B. | 阿伏伽德罗常数即为0.012kg12C所含的碳原子数 | |
| C. | 任何气体的摩尔体积均约为22.4L.mol-1 | |
| D. | 一个标准大气压下4℃时,9mL水中所含电子数约为3.01×1024. |
12.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L乙醇中含有的碳氢键数为2.5NA | |
| B. | 常温常压下,28gC2H4、CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 常温下,20LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| D. | 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |