题目内容
12.甲醇可作为燃料电池的原料.(1)以CH4和H2O为原料,通过下列反应来制备甲醇.
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )△H=+206.0kJ•mol-1
Ⅱ:CO ( g )+2H2 ( g )=CH3OH ( g )△H=-129.0kJ•mol-1
则:CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77.0 kJ•mol-1.
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.
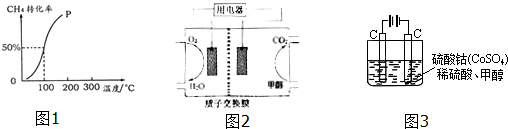
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.003 mol•L-1•min-1.
②100℃时反应I的平衡常数为2.25×10-4.
(3)在压强为0.1MPa、温度为300℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的$\frac{1}{2}$,其他条件不变,对平衡体系产生的影响是CD (填字母序号).
A.c ( H2 )减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡c ( H2 )/c (CH3OH )减小 E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图2装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+.
②写出除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6 Co2++6H+.
(5)以甲醇可作为燃料制成燃料电池结构示意图如图3所示.关于该电池的叙述正确的是B.
A.当电池反应消耗了2mol甲醇时,溶液中转移了12NA个e-
B.电池的负极反应为:CH3OH+H2O-6e-=CO2↑+6H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体(22.4/3)L.
分析 (1)I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )△H=+206.0kJ•mol-1
Ⅱ:CO ( g )+2H2 ( g )=CH3OH ( g )△H=-129.0kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ可得:CH4(g)+H2O(g)=CH3OH (g)+H2(g),反应热也相加;
(2)100℃时达到平衡时,甲烷的转化率为50%,转化的甲烷为0.5mol,则:
CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )
起始量(mol):1 2 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①根据v=$\frac{\frac{△n}{V}}{△t}$计算用H2表示的平均反应速率;
②计算平衡浓度,代入K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$计算平衡常数;
(3)A.体积压缩,反应混合物各组分浓度都增大;
B.体积压缩,压强增大,正逆反应速率都增大;
C.体积压缩,压强增大,平衡正向移动;
D.体积压缩,压强增大,平衡正向移动,氢气物质的量减小、甲醇物质的量增大;
E.温度不变,平衡常数不变;
(4)①阳极发生氧化反应,由题目信息可知,阳极上Co2+失去电子氧化生成Co3+;
②由题目信息可知,Co3+将甲醇氧化成CO2,自身被还原为Co2+;
(5)A.电解质溶液中没有电子通过,离子定向移动形成电流;
B.负极发生氧化反应,甲醇在负极失去电子,酸性条件下生成二氧化碳,由电荷守恒可知还有氢离子生成;
C.放电过程属于原电池,电解质溶液中阳离子向正极移动;
D.根据电子转移守恒计算生成二氧化碳的体积.
解答 解:(1)I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )△H=+206.0kJ•mol-1
Ⅱ:CO ( g )+2H2 ( g )=CH3OH ( g )△H=-129.0kJ•mol-1
根据盖斯定律,Ⅰ+Ⅱ可得:CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77.0 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g)△H=+77.0 kJ•mol-1;
(2)100℃时达到平衡时,甲烷的转化率为50%,转化的甲烷为0.5mol,则:
CH4 ( g )+H2O ( g )=CO ( g )+3H2 ( g )
起始量(mol):1 2 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①用H2表示的平均反应速率为$\frac{\frac{1.5mol}{100L}}{5min}$=0.003 mol•L-1•min-1,故答案为:0.003 mol•L-1•min-1;
②平衡常数K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{\frac{0.5}{100}×(\frac{1.5}{100})^{3}}{\frac{0.5}{100}×\frac{1.5}{100}}$=2.25×10-4,故答案为:2.25×10-4;
(3)A.体积压缩,反应混合物各组分浓度都增大,故A错误;
B.体积压缩,压强增大,正逆反应速率都增大,正反应速率增大更多,故B错误;
C.体积压缩,压强增大,平衡正向移动,CH3OH 的物质的量增大,故C正确;
D.体积压缩,压强增大,平衡正向移动,氢气物质的量减小、甲醇物质的量增大,重新平衡c ( H2 )/c (CH3OH )减小,故D正确;
E.温度相同,则平衡常数相同,故E错误,
故选:CD;
(4)①阳极发生氧化反应,由题目信息可知,阳极上Co2+失去电子氧化生成Co3+,阳极电极反应式为Co2+-e-=Co3+,故答案为:Co2+-e-=Co3+;
②由题目信息可知,Co3+将甲醇氧化成CO2,自身被还原为Co2+,反应离子方程式为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
(5)A.电解质溶液中没有电子通过,离子定向移动形成电流,故A错误;
B.负极发生氧化反应,甲醇在负极失去电子,酸性条件下生成二氧化碳,由电荷守恒可知还有氢离子生成,电极反应式为:CH3OH+H2O-6e-=CO2↑+6H+,故B正确;
C.放电过程属于原电池,电解质溶液中阳离子向正极移动,即H+从负极区向正极区迁移,故C错误;
D.根据电子转移守恒,生成二氧化碳为$\frac{1mol×4}{4-(-2)}$=$\frac{2}{3}$mol,则标况下生成二氧化碳为$\frac{2}{3}$mol×22.4L/mol=$\frac{44.8}{3}$L,故D错误,
故选:B.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、热化学方程式、电化学等,题目综合性较大,需要学生具备扎实的基础与灵活运用能力,难度中等.

| A. | 煤油 | B. | 液氨 | C. | 氯仿 | D. | 乙醇 |
 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器中,发生反应A(g)+B(g)?xC(g)+D(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间的变化如图所示.下列说法正确的是( )| A. | 反应方程式中的x=1 | |
| B. | t2时刻改变的条件是使用催化剂 | |
| C. | t3时刻改变的条件是移去少量物质D | |
| D. | t1~t3间该反应的平衡常数均为4 |
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 ①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).
①实验1中以v (CO2) 表示的反应速率为0.13mol/(L.min); (取小数二位,下同).②该反应为吸(填“吸”或“放”)热反应,实验2条件下平衡常数K=$\frac{1}{6}$.
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol.
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
①该电池正极的电极反应为O2+2H2O+4e-=4OH-.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为2CH3OH+3O2+4KOH=2K2CO3+6H2O.
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
| A. | NF3气体密度比空气小 | B. | 过程N(g)+3F(g)→NF3(g)放出热量 | ||
| C. | NF3属于易燃、高能物质 | D. | NF3室温条件下不稳定 |

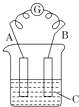 如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.