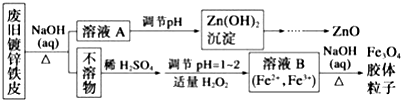
题目内容
13.某同学预设计实验测定H2在通常状况下的摩尔体积,设计如下实验步骤:①连接如右图所示装置,并检查装置的气密性②向a仪器中装入VmL稀盐酸,锥形瓶中加入锌粒,B中加入碱石灰;
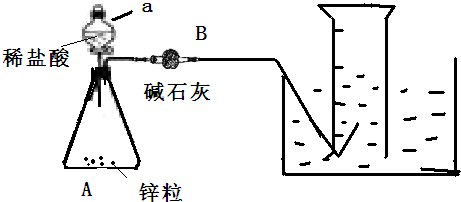
③称取A装置和B仪器和药品的总质量,记为a g;
④采取措施使装置A中发生反应;
⑤反应停止后,测得在通常状况下收集的气体体积为b mL;
⑥再次称量A装置和B仪器得总质量(含内装物质),记为c g;
⑦处理数据等.
(1)写出A仪器中发生反应的化学方程式Zn+2HCl═ZnCl2+H2↑
(2)写出检查该装置气密性的方法关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好
(3)A装置中仪器a的名称为分液漏斗
(4)若拆除B仪器(其他仪器不变),会(填“会”或“不会”) 对本实验产生影响,理由是H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响
(5)根据上述数据,计算在通常状况下,H2的摩尔体积Vm=$\frac{2b×1{0}^{-3}}{a-c}$L/mol(用含a、b、c等字母的代数式表示)
分析 (1)A仪器中利用盐酸与锌发生置换反应生成氢气和氯化锌;
(2)根据压强差的原理可以检查该装置气密性;
(3)根据装置图可知A装置中仪器a的名称;
(4)B仪器中装有碱石灰,可以吸收氢气中的氯化氢气体;
(5)根据上述数据可知,氢气的体积为b mL,氢气的质是为ag-cg,所以氢气物质的量为$\frac{a-c}{2}$mol,据此计算H2的摩尔体积.
解答 解:(1)A仪器中利用盐酸与锌发生置换反应生成氢气和氯化锌,反应的方程式为Zn+2HCl═ZnCl2+H2↑,
故答案为:Zn+2HCl═ZnCl2+H2↑;
(2)根据压强差的原理可以检查该装置气密性,具体操作为关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好,
故答案为:关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好;
(3)根据装置图可知A装置中仪器a的名称为分液漏斗,
故答案为:分液漏斗;
(4)B仪器中装有碱石灰,可以吸收氢气中的氯化氢气体,所以若拆除B仪器,H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响,
故答案为:会;H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响;
(5)根据上述数据可知,氢气的体积为b mL,氢气的质是为ag-cg,所以氢气物质的量为$\frac{a-c}{2}$mol,H2的摩尔体积Vm=$\frac{b×1{0}^{-3}L}{\frac{a-c}{2}mol}$=$\frac{2b×1{0}^{-3}}{a-c}$L/mol,
故答案为:$\frac{2b×1{0}^{-3}}{a-c}$L/mol.
点评 本题以氢气的摩尔体积测定为载体,考查实验基本技能与操作、对实验装置的理解分析、化学计算等,本题测重基本实验操作能力和计算的考查,是对学生综合能力的考查,难度中等.

| A. | 煤油 | B. | 液氨 | C. | 氯仿 | D. | 乙醇 |
| A. | NF3气体密度比空气小 | B. | 过程N(g)+3F(g)→NF3(g)放出热量 | ||
| C. | NF3属于易燃、高能物质 | D. | NF3室温条件下不稳定 |
| A. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-═SO42-+Cl-+2HClO | |
| B. | 用氨水溶解氯化银沉淀:Ag++2 NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |

请回答下列问题:
①写出能表示硫的燃烧热的热化学方程式:S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1.
②△H2=-78.64 kJ/mol.
③在相同条件下,充入1mol SO3和0.5mol O2,则达到平衡时SO3的转化率为20%;此时该反应吸收(填“放出”或“吸收”)19.66 kJ的能量.
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C(填序号).
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
B.高温使水分解制氢:2H2O(g)$\frac{\underline{\;高温\;}}{\;}$2H2+O2↑
C.太阳光催化分解水制氢:2H2O $\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳光}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g) $\stackrel{高温}{?}$CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图2所示.
从3min到9min,υ(H2)=0.125 mol/(L•min).
③能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.3个H-H键断裂的同时有4个C-H键断裂
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该可逆反应的正反应是放热反应
B.在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO的转化率为50%,则此时的平衡常数为100
C.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气的转化率最高.

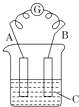 如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.